Undersøgelse detaljerede regulering af en multi-drug transporter

(venstre mod højre):Reza Dastvan, Ph.d., Smriti Mishra, Ph.d., og Hassane Mchaourab, Ph.d., studerer den indre funktion af en proteinpumpe, der bidrager til kemoterapiresistens mod kræft. Kredit:Vanderbilt University
Forskere fra Vanderbilt University har opdaget, hvordan en proteinpumpe skelner mellem kemikalier, som den vil udstøde fra en celle, og hæmmere, der blokerer dens virkning.
Pumpen, kaldet P-glykoprotein, beskytter cellerne ved at fjerne potentielt skadelige kemikalier, men det bidrager til lægemiddelresistens, når disse kemikalier er terapeutiske lægemidler - hvilket udgør et særligt problem for kræftbehandling. De nye fund, rapporteret i journalen Videnskab , kunne guide udviklingen af mere effektive hæmmere til at forhindre kræftcelleresistens over for kemoterapi.
Undersøgelserne besvarede et langvarigt spørgsmål om P-glycoprotein, sagde Hassane Mchaourab, Ph.D., Louise B. McGavock professor i molekylær fysiologi og biofysik.
Mchaourab beskriver P-glycoprotein som en todelt molekylær maskine:en motor, der forbrænder ATP og et transmembrant domæne, der giver en passage for substratet (et molekyle, der flyttes af transportøren). ATP-energi udnyttet af motoren driver de konformationelle ændringer, der flytter kemikalier ud af celler.
Hvad der ikke var klart, er "hvordan ATP-motoren ved, at et kemikalie er bundet i det transmembrane domæne, der er en molekylær 'mile' væk, "Sagde Mchaourab.
"Hos mennesker, denne transportør spytter kemikalier ud, der inkluderer antibiotika, anti-cancer kemoterapi medicin, antidepressiva, opioider … hvad gør et molekyle til et substrat for denne bemærkelsesværdigt mangfoldige pumpe, og hvad gør et molekyle til en inhibitor?"
De nuværende undersøgelser følger resultater, som Mchaourab og hans kolleger rapporterede i tidsskriftet Natur to år siden. P-glykoprotein har to ATP-forbrændingssteder, og forskerne opdagede ved hjælp af en spektroskopimetode (dobbelt elektron-elektron resonans, DEER), at de to steder er strukturelt asymmetriske - først det ene sted og derefter det andet sted brænder ATP. De fandt også, at de to sekventielle trin er relateret til substratgenkendelse.
Mchaourab husker Vanderbilt University Medical Centers videnskabsforfatter Bill Snyder, der stillede et spørgsmål, der gav ham en pause - hvorfor skulle naturen designe en asymmetrisk motor?
"Jeg svarede, at det måske er den måde, transportøren ved, om den er fyldt med substrat eller ej, "Mchaourab sagde." Men vi havde gjort alle vores eksperimenter med tilstedeværende substrat-for sådan fungerer transportøren. "Forskerne havde ikke undersøgt strukturen af ATP-brændingsstederne i fravær af substrat.
"Det var en fredag, og jeg vågnede den aften og tænkte på Bills spørgsmål, "Mchaourab huskede." I mandags, Jeg bad Reza (en postdoc) om at gentage eksperimenterne og fjerne substratet. Og voila, motoren blev symmetrisk - det var ligegyldigt, hvilken side der først brændte ATP. "
I yderligere undersøgelser med P-glycoprotein tredje generations hæmmere, forskerne fandt ud af, at disse inhibitorer også stabiliserer en symmetrisk tilstand, men en, der er forskellig fra den tomme tilstand.
"En inhibitor binder transportøren, så den ikke kan gå til den asymmetriske tilstand og ikke kan udføre kraftslaget - det trin, hvor transportøren bevæger sig fra det, vi kalder indadvendt til udadvendt og spytter ud substrat, " sagde Mchaourab.
At kende de forskellige konformationer af P-glycoprotein, der stabiliseres af substrater versus inhibitorer, vil gøre det muligt at screene for mere effektive inhibitormolekyler. Det kan også hjælpe forskere med at forstå, hvorfor eksisterende hæmmere klarede sig dårligt i kliniske forsøg.
"P-glycoprotein er et så vigtigt klinisk mål, "Mchaourab sagde. "Nu indser vi, at inhibitorer også virker på motorens asymmetri. P-glykoprotein ved, om det er tomt, eller hvis det er bundet til et substrat eller en hæmmer ved at modulere niveauet af asymmetri. "
 Varme artikler
Varme artikler
-
 Energieffektiv grøn vej til magnesiumproduktion(Venstre) Faktisk pellet af dolomit og ferrosilicium. Den hvide del er rig på dolomit, og den sorte del er rig på ferrosilicium. Ferrosilicium er koncentreret i den midterste del. (Højre) Fem stablet
Energieffektiv grøn vej til magnesiumproduktion(Venstre) Faktisk pellet af dolomit og ferrosilicium. Den hvide del er rig på dolomit, og den sorte del er rig på ferrosilicium. Ferrosilicium er koncentreret i den midterste del. (Højre) Fem stablet -
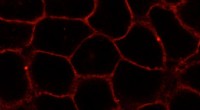 Hvordan forskere analyserer cellemembranerEn ny forbindelse, der efterligner naturligt kolesterol i membraner af levende celler (her:HeLa-celler). Stoffet er mærket med et fluorescerende farvestof (rødt). Kredit:L. Rakers et al./ Cell Chem B
Hvordan forskere analyserer cellemembranerEn ny forbindelse, der efterligner naturligt kolesterol i membraner af levende celler (her:HeLa-celler). Stoffet er mærket med et fluorescerende farvestof (rødt). Kredit:L. Rakers et al./ Cell Chem B -
 Power-to-gas anlæg med høj effektivitetDemonstrationsfaciliteten i HELMETH-projektet kombinerer metanering (venstre) og elektrolyse (højre) med en effektivitet på 76 procent. Kredit:sunfire GmbH Naturgasnettet kan fungere som buffer fo
Power-to-gas anlæg med høj effektivitetDemonstrationsfaciliteten i HELMETH-projektet kombinerer metanering (venstre) og elektrolyse (højre) med en effektivitet på 76 procent. Kredit:sunfire GmbH Naturgasnettet kan fungere som buffer fo -
 Ny indsigt i træning af højreaktive kemiske forbindelserDr. Jonas Warneke forklarer kemien bag meget reaktive molekyler, som forskes på Wilhelm Ostwald Instituttet. Kredit:Universität Leipzig Meget reaktive molekyler kan ikke overleve længe i naturen.
Ny indsigt i træning af højreaktive kemiske forbindelserDr. Jonas Warneke forklarer kemien bag meget reaktive molekyler, som forskes på Wilhelm Ostwald Instituttet. Kredit:Universität Leipzig Meget reaktive molekyler kan ikke overleve længe i naturen.
- IMAGE-satellitterne vender forbløffende tilbage
- Batteri og hukommelsesenhed i ét:Fremtidige nanoelektroniske informationslagringsenheder er også s…
- Kræftvaccine pakket i små partikler
- Sluk kameraet under virtuelle møder, siger miljøundersøgelse
- Efterhånden som tømmerpriserne stiger i vejret, professor udvikler metode til at forudsige fremtid…
- Fiskediversitet knyttet til caribisk koralrevs sundhed


