Hvad er den molekylære geometri af brom pentafluorid?
Her er hvorfor:
* Centralatom: Brom (BR) er det centrale atom.
* Valenselektroner: Bromin har 7 valenselektroner, og hver fluor (F) atom har 7 valenselektroner.
* Samlede valenselektroner: 7 (Br) + 5 * 7 (f) =42 elektroner.
* Elektronpar: 42 Elektroner / 2 elektroner pr. Binding =21 elektronpar.
* limningspar: 5 BR-F-obligationer =5 bindingspar.
* Ensomme par: 21 Samlede par - 5 bindingspar =16 ensomme par. Da vi fokuserer på det centrale atom, betragter vi imidlertid kun dets ensomme par. Brom har et ensomt par.
VSEPR -teorien (Valence Shell Electron Pair Repulsion) hjælper os med at forudsige formen:
* Det centrale bromatom har 5 bindingspar og et ensomt par, hvilket resulterer i i alt 6 elektrondomæner.
* Baseret på VSEPR -teori fører 6 elektrondomæner omkring et centralt atom til en octahedral elektrongeometri.
* Det ensomme par optager mere plads end bindingsparene og forvrænger den ideelle octahedrale geometri. Dette skubber de fem fluoratomer ind i en firkantet pyramidal form.
Derfor er den molekylære geometri af brom pentafluorid firkantet pyramidal .
 Varme artikler
Varme artikler
-
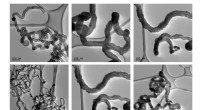 Fra genbrug til upcycling:En smartere måde at håndtere plast påEksempler på carbon nanorør produceret med den nye tilgang, ved forskellige forstørrelser. Kredit:RMIT University Globalt genbruges kun omkring 20% af affaldsplast. At øge dette tal er stadig en
Fra genbrug til upcycling:En smartere måde at håndtere plast påEksempler på carbon nanorør produceret med den nye tilgang, ved forskellige forstørrelser. Kredit:RMIT University Globalt genbruges kun omkring 20% af affaldsplast. At øge dette tal er stadig en -
 Ingeniører modellerer nanoskala krystaldynamik i system, der er let at seI en Rice University-undersøgelse omkonfigureres et polykrystallinsk materiale, der spinder i et magnetfelt, efterhånden som korngrænser vises og forsvinder på grund af cirkulation ved hulrummenes græ
Ingeniører modellerer nanoskala krystaldynamik i system, der er let at seI en Rice University-undersøgelse omkonfigureres et polykrystallinsk materiale, der spinder i et magnetfelt, efterhånden som korngrænser vises og forsvinder på grund af cirkulation ved hulrummenes græ -
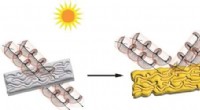 Lyser på, hvorfor plastik bliver gultKredit:ACS Applied Polymer Materials (2022). DOI:10.1021/acsapm.2c00877 Hvis du ejer en retro spillekonsol eller har en gammel rulle indpakningstape, har du set, hvordan plast bliver gult, når det
Lyser på, hvorfor plastik bliver gultKredit:ACS Applied Polymer Materials (2022). DOI:10.1021/acsapm.2c00877 Hvis du ejer en retro spillekonsol eller har en gammel rulle indpakningstape, har du set, hvordan plast bliver gult, når det -
 Sollys-drevet fotokatalytisk vandopdeling til brintproduktion i stor skalaPanoramaudsigt over brintproduktionens fotokatalytiske panelreaktionssystem. Kredit:Tilpasset fra Nishiyama, H., Yamada, T., Nakabayashi, M. et al. Storstilet solbrintproduktion gennem vandopdelin
Sollys-drevet fotokatalytisk vandopdeling til brintproduktion i stor skalaPanoramaudsigt over brintproduktionens fotokatalytiske panelreaktionssystem. Kredit:Tilpasset fra Nishiyama, H., Yamada, T., Nakabayashi, M. et al. Storstilet solbrintproduktion gennem vandopdelin
- Hvorfor får forskellige dele af jorden sol?
- Hvilken type væv har en apikal og basal overflade?
- Form for materie, der findes i belysningsbolte atomreaktorer og stjerner?
- Påvirker længden af en model -raket dens afstand?
- Hvad er oxidationstallet for O i Fe2O3?
- Undersøgelse finder stigning i uligheder mellem arbejdspladser i USA, højindkomstlande


