Hvorfor er CUCL mere kovalent end NaCl?
1. Elektronegativitetsforskel:
* Elektronegativitet: Dette er et mål for et atoms evne til at tiltrække elektroner i en binding.
* NaCl: Natrium (NA) har en lav elektronegativitet (0,93), og chlor (CL) har en høj elektronegativitet (3,16). Forskellen er stor (2.23). Denne signifikante forskel fører til en meget polær binding, hvor elektronerne trækkes stærkt mod kloratomet. Dette resulterer i en overvejende ionisk karakter.
* cucl: Kobber (Cu) har en højere elektronegativitet (1,90) sammenlignet med natrium. Elektronegativitetsforskellen mellem kobber og klor er mindre (1,26). Denne mindre forskel betyder, at bindingen er mindre polariseret, og elektronerne deles mere jævnt mellem kobber- og kloratomer, hvilket fører til en større kovalent karakter.
2. Metallisk karakter:
* kobber: Kobber er et overgangsmetal og udviser betydelig metallisk karakter. Dette betyder, at det har en tendens til at danne metalliske bindinger, som er kendetegnet ved delokaliserede elektroner. I CUCL bidrager denne metalliske karakter til bindingens kovalente karakter.
* natrium: Natrium er et meget reaktivt alkalimetal, og dets metalliske karakter er mindre udtalt end kobber.
3. Polarisering:
* Den mindre størrelse af kobberion (Cu+) sammenlignet med natriumion (Na+) gør det mere polariserende. Dette betyder, at det kan fordreje elektronskyen af kloratomet, hvilket yderligere bidrager til bindingens kovalente karakter.
Kortfattet:
Kombinationen af en mindre elektronegativitetsforskel, den metalliske karakter af kobber og dens polariserende evne fører til, at CUCL har en mere kovalent karakter end NaCl.
Vigtig note: Det er vigtigt at forstå, at sondringen mellem ionisk og kovalent binding ofte er et spektrum. Mens NaCl overvejende er ionisk, og CUCL er mere kovalent, udviser begge forbindelser en vis grad af begge typer binding.
Sidste artikelHvad hedder navnet og formlen for sammensat PB4 NO3-?
Næste artikelHvor mange atomer indeholder et molekyle metan?
 Varme artikler
Varme artikler
-
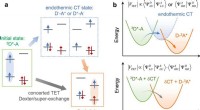 Endoterm ladningsoverførsel medierer overfladeafstandsafhængig trilling energimigrationen skematisk afbildning af de indledende og endelige tilstande og mellemliggende endoterme CT -tilstande. 3D* -A og D-3A* er de indledende og sidste tilstande, henholdsvis, der henviser til, at D −- A
Endoterm ladningsoverførsel medierer overfladeafstandsafhængig trilling energimigrationen skematisk afbildning af de indledende og endelige tilstande og mellemliggende endoterme CT -tilstande. 3D* -A og D-3A* er de indledende og sidste tilstande, henholdsvis, der henviser til, at D −- A -
 Biologi og kemi kombineres for at generere nye antibiotikaFrugtlegemer fra svampen Clitopilus passeckerianus genereret i laboratoriet. Kredit:University of Bristol Kombinerer innovationerne inden for syntetisk biologi med biologi og kemi, et team af vi
Biologi og kemi kombineres for at generere nye antibiotikaFrugtlegemer fra svampen Clitopilus passeckerianus genereret i laboratoriet. Kredit:University of Bristol Kombinerer innovationerne inden for syntetisk biologi med biologi og kemi, et team af vi -
 Grøn katalyseteknik har til formål at øge effektiviteten af den farmaceutiske fremstillingDiagram af den mikrosfærepakkede, rørreaktor brugt i den nye pseudo-homogene katalyseteknik. Kredit:Milad Abolhasani Omkring 70 procent af lægemidlerne er fremstillet ved hjælp af palladiumdrevne
Grøn katalyseteknik har til formål at øge effektiviteten af den farmaceutiske fremstillingDiagram af den mikrosfærepakkede, rørreaktor brugt i den nye pseudo-homogene katalyseteknik. Kredit:Milad Abolhasani Omkring 70 procent af lægemidlerne er fremstillet ved hjælp af palladiumdrevne -
 Forskere finder en måde at skrælle slimede biofilm som gamle klistermærkerKredit:Princeton University Slimet, svært at rengøre bakteriemåtter kaldet biofilm forårsager problemer lige fra medicinske infektioner til tilstoppede afløb og tilsmudset industriudstyr. Nu, fors
Forskere finder en måde at skrælle slimede biofilm som gamle klistermærkerKredit:Princeton University Slimet, svært at rengøre bakteriemåtter kaldet biofilm forårsager problemer lige fra medicinske infektioner til tilstoppede afløb og tilsmudset industriudstyr. Nu, fors
- Atomisk Struktur af Stål
- Stigning i ekstreme havniveauer kan bringe europæiske kystsamfund i fare
- Hvilken type bjerg er den modige provins og rækkevidde, der er kendetegnet ved mange normale fejl?
- Hvad kaldes tilstedeværelse af sten?
- Hvilken type blad ville være bedst egnet til et meget solrigt klima, og hvorfor?
- 3D-print kan nu fremstille skræddersyede sensorer til robotter, pacemakere og mere


