Hvad sker der med kobber, når de dyppes i sølvnitratopløsning?
* sølvkrystaller form på kobberoverfladen: Kobber er mere reaktiv end sølv. Dette betyder, at kobber kan fortrænge sølv fra dets sammensætning. Sølvioner (Ag+) i sølvnitratopløsningen reagerer med kobberet, hvilket får fast sølv (Ag) til at deponere på kobberoverfladen. Dette skaber en sølvfarvet belægning på kobberet.
* Løsningen bliver blå: Når kobberatomer mister elektroner til dannelse af kobber (II) -ioner (Cu2+), opløses de i opløsningen. Disse kobberioner giver opløsningen en karakteristisk blå farve.
Her er den kemiske ligning:
Cu (s) + 2agno₃ (aq) → Cu (no₃) ₂ (aq) + 2ag (s)
Forklaring:
* cu (s): Fast kobber
* agno₃ (aq): Sølvnitratopløsning (vandig)
* cu (no₃) ₂ (aq): Kobber (II) Nitratopløsning (vandig)
* 2ag (r): Solid sølv
Kortfattet: Kobber reagerer med sølvnitrat for at fortrænge sølv og danner en sølvbelægning på kobber og en blå kobber (II) nitratopløsning.
 Varme artikler
Varme artikler
-
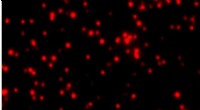 En meget følsom ny blodprøve kan påvise sjældne kræftproteinerDette SMAC -billede viser mutante p53 -proteiner i blodet hos en kræftpatient i æggestokkene. Individuelle klynger af p53 -molekyler er repræsenteret af røde pletter. Kredit:Shih-Chin Wang Protein
En meget følsom ny blodprøve kan påvise sjældne kræftproteinerDette SMAC -billede viser mutante p53 -proteiner i blodet hos en kræftpatient i æggestokkene. Individuelle klynger af p53 -molekyler er repræsenteret af røde pletter. Kredit:Shih-Chin Wang Protein -
 AFRL opnår chokerende materialeteknologi -gennembrudEt forskningshold fra Air Force Research Laboratory har udviklet en 3-D-printet polymerbaseret skumstruktur, der reagerer på kraften fra en stødbølge og fungerer som en envejskontakt. Disse billeder v
AFRL opnår chokerende materialeteknologi -gennembrudEt forskningshold fra Air Force Research Laboratory har udviklet en 3-D-printet polymerbaseret skumstruktur, der reagerer på kraften fra en stødbølge og fungerer som en envejskontakt. Disse billeder v -
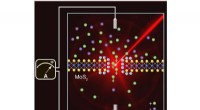 Produktion af elektricitet ved flodmundinger ved hjælp af lys og osmoseGengivelse af de forhold, der opstår ved flodmundinger, EPFL -forskere skinnede lys på et system, der kombinerer vand, salt og en membran på kun tre atomer tykke for at generere mere elektricitet. Kre
Produktion af elektricitet ved flodmundinger ved hjælp af lys og osmoseGengivelse af de forhold, der opstår ved flodmundinger, EPFL -forskere skinnede lys på et system, der kombinerer vand, salt og en membran på kun tre atomer tykke for at generere mere elektricitet. Kre -
 Forskere finder potentiale i miljøvenlig synthesizerDisse rombeformede partikler scanner elektronmikrofotografier af en organisk metalramme, kaldet ZIF-8, syntetiseret i superkritisk kuldioxid (scCO2). PNNL -forskere har rapporteret, at scCO2, et vigti
Forskere finder potentiale i miljøvenlig synthesizerDisse rombeformede partikler scanner elektronmikrofotografier af en organisk metalramme, kaldet ZIF-8, syntetiseret i superkritisk kuldioxid (scCO2). PNNL -forskere har rapporteret, at scCO2, et vigti
- Hvordan kan størrelsen til flux-konvertering beregnes nøjagtigt til astronomiske observationer?
- Hvad gør klor?
- Kan kold energi overføres til et objekt?
- Lys fra en stjerne opsamles af konkavt spejl Hvor langt billedet af hvis radius krumning 150 cm?
- Hvad er den dominerende proces med at forme landskabet?
- Hvad er silikatmineraler?


