Hvorfor udtrykket molekyle er passende til hydrogenchlorid, men ikke natriumchlorid?
* hydrogenchlorid (HCL): HCL er en kovalent forbindelse . Dette betyder, at brint- og chloratomer deler elektroner til dannelse af en stabil binding. De delte elektroner skaber et molekyle, en diskret enhed på to eller flere atomer, der holdes sammen af kovalente bindinger.
* natriumchlorid (NaCl): NaCl er en ionisk forbindelse . Dette betyder, at natrium (NA) mister et elektron for at blive en positivt ladet ion (Na+), og klor (CL) får, at elektronet bliver en negativt ladet ion (Cl-). Disse modsatte ladede ioner tiltrækker hinanden elektrostatisk og danner en krystalgitter . Der er ingen diskrete molekyler i en ionisk forbindelse - det er en kontinuerlig, gentagende række ioner.
Kortfattet:
* molekyler dannes af kovalente bindinger, hvor atomer deler elektroner.
* ioniske forbindelser er dannet af elektrostatiske attraktioner mellem modsat ladede ioner og danner ikke diskrete molekyler.
Derfor kaldes HCL korrekt et molekyle, mens NaCl ikke er det.
Sidste artikelHvorfor er Valency of Na ikke 4 i NaCl -krystal?
Næste artikelHvad sker der med kobber, når de dyppes i sølvnitratopløsning?
 Varme artikler
Varme artikler
-
 Designede molekyler fjerner selektivt uønskede ioner fra komplekse løsninger til energiproduktionSpecifikke ioner kan fanges ved hjælp af designede molekylære chelatorer lige fra foldamerer til chlorid, tetraurinstofchelater til sulfat, fastspændte calixpyrroler til lithiumnitrat, og calixcrowns
Designede molekyler fjerner selektivt uønskede ioner fra komplekse løsninger til energiproduktionSpecifikke ioner kan fanges ved hjælp af designede molekylære chelatorer lige fra foldamerer til chlorid, tetraurinstofchelater til sulfat, fastspændte calixpyrroler til lithiumnitrat, og calixcrowns -
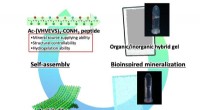 Bioinspireret mineralisering af calciumcarbonat i peptidhydrogelBioinspireret mineralisering. Kredit:Kazuki Murai et al., Journal of Asian Ceramic Societies, Taylor og Francis Et team af forskere har udviklet en biomimetisk mineralisering af calciumcarbonat ve
Bioinspireret mineralisering af calciumcarbonat i peptidhydrogelBioinspireret mineralisering. Kredit:Kazuki Murai et al., Journal of Asian Ceramic Societies, Taylor og Francis Et team af forskere har udviklet en biomimetisk mineralisering af calciumcarbonat ve -
 Seneste fremskridt i faststof-NMR-undersøgelser af zeolitkatalysatorer(a) 2D refokuseret UTIDSÆSTLIGT (J-medieret) 29Si{29Si} DQ NMR-spektrum af as-syntetiseret zeolit ITW. (b) DNP-forstærket 2D 29Si{29Si} J-medieret korrelationsspektrum af calcineret Si-SSZ-70. (c) S
Seneste fremskridt i faststof-NMR-undersøgelser af zeolitkatalysatorer(a) 2D refokuseret UTIDSÆSTLIGT (J-medieret) 29Si{29Si} DQ NMR-spektrum af as-syntetiseret zeolit ITW. (b) DNP-forstærket 2D 29Si{29Si} J-medieret korrelationsspektrum af calcineret Si-SSZ-70. (c) S -
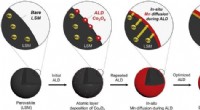 Ny katalysator giver et boost til næste generations EV-batterierSkematisk illustration af det selvrekonstruerede mellemlag i LSM-20-Co afledt af in-situ Mn-diffusion via gentagne atomlagsaflejringscyklusser. Kredit:UNIST Metal-luft-batterier (MABer), som bruge
Ny katalysator giver et boost til næste generations EV-batterierSkematisk illustration af det selvrekonstruerede mellemlag i LSM-20-Co afledt af in-situ Mn-diffusion via gentagne atomlagsaflejringscyklusser. Kredit:UNIST Metal-luft-batterier (MABer), som bruge


