Hvorfor er Valency of Na ikke 4 i NaCl -krystal?
* Elektronisk konfiguration: Natrium har en elektronisk konfiguration af 1s² 2s² 2p⁶ 3S¹. Det har en elektron i sin yderste skal (Valence Shell). For at opnå en stabil oktet har den en tendens til at miste denne ene elektron og blive en positivt ladet ion (Na⁺).
* ionisk binding: Natriumchlorid (NaCI) dannes gennem ionisk binding. Natrium mister sin ene elektron til klor, som har syv elektroner i sin yderste skal. Klor vinder dette elektron for at afslutte sin oktet og blive en negativt ladet ion (CL⁻).
* Elektrostatisk attraktion: De modsatte ladede ioner (Na⁺ og Cl⁻) tiltrækker hinanden stærkt og danner en krystalgitterstruktur. Den ioniske binding er et resultat af denne elektrostatiske attraktion.
hvorfor ikke +4?
* Energikrav: For at natrium skal opnå en +4 valency, er det nødvendigt at miste fire elektroner. Dette ville kræve en betydelig mængde energi, hvilket gør det meget usandsynligt at forekomme.
* stabilitet: En +4 valency ville efterlade natrium med en meget ustabil konfiguration, langt fra den stabile octet -regel.
Kortfattet: Natriums elektroniske konfiguration og arten af ionisk binding fører til en +1 valens i NaCI, hvilket resulterer i en stabil og energisk gunstig forbindelse.
 Varme artikler
Varme artikler
-
 Enkelte atomer som katalysatorBrug af enkeltatomer sænker omkostningerne ved katalysatorer. Kredit:Vienna University of Technology Årevis, metalnanopartiklerne brugt i katalysatorer er blevet mindre og mindre. Nu, et forskerho
Enkelte atomer som katalysatorBrug af enkeltatomer sænker omkostningerne ved katalysatorer. Kredit:Vienna University of Technology Årevis, metalnanopartiklerne brugt i katalysatorer er blevet mindre og mindre. Nu, et forskerho -
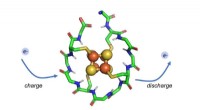 Forskere identificerer protein, der kan have eksisteret, da livet begyndteForskere har designet et syntetisk lille protein, der ombrydes omkring en metalkerne sammensat af jern og svovl. Dette protein kan gentagne gange oplades og udledes, gør det muligt for den at transpor
Forskere identificerer protein, der kan have eksisteret, da livet begyndteForskere har designet et syntetisk lille protein, der ombrydes omkring en metalkerne sammensat af jern og svovl. Dette protein kan gentagne gange oplades og udledes, gør det muligt for den at transpor -
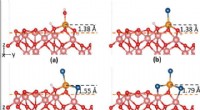 Supercomputermodeller beskriver chlorids rolle i korrosionOverfladestrukturelle ændringer af passive jernfilm forårsaget af adsorption af OH og/eller Cl. (a) Fe (OH) 3, (b) Fe(OH)2Cl, (c) Fe (OH) Cl2, (d) FeCl3. Placeringen af kant-Fe-atomet før adsorption
Supercomputermodeller beskriver chlorids rolle i korrosionOverfladestrukturelle ændringer af passive jernfilm forårsaget af adsorption af OH og/eller Cl. (a) Fe (OH) 3, (b) Fe(OH)2Cl, (c) Fe (OH) Cl2, (d) FeCl3. Placeringen af kant-Fe-atomet før adsorption -
 Ny forskning giver bedre forståelse af hudens holdbarhedKredit:Unsplash/CC0 Public Domain Som en, der grundigt har studeret, hvad naturen har frembragt, kan lektor Guy German godt lide at fortælle sine elever:Du tror, du er en god ingeniør, men evolut
Ny forskning giver bedre forståelse af hudens holdbarhedKredit:Unsplash/CC0 Public Domain Som en, der grundigt har studeret, hvad naturen har frembragt, kan lektor Guy German godt lide at fortælle sine elever:Du tror, du er en god ingeniør, men evolut
- Malawi henvender sig til britiske tropper i krybskytteri
- Gadgets:Udskrivning uden blæk? Ja
- Hvorfor er atomet for technetium elektrisk neutral?
- Hvad er eksemplerne på produktteknologi?
- Hvad er mængden af tilgængelig energi, der kan bruges til at fremme forandring, fungerer arbejde…
- Hvis et fly flyver vandret, skal dens vægt afbalanceres af hvilken kraft?


