Forklar hvorfor natrium kun findes i forbindelser naturen?
* Høj reaktivitet: Natrium er meget reaktiv, især med vand og ilt. Det reagerer let med disse elementer og danner forbindelser som natriumhydroxid (NaOH) og natriumoxid (Na2O).
* Elektropositiv karakter: Natrium har en lav ioniseringsenergi, hvilket betyder, at den let mister sin ydre elektron for at blive positivt ladet (Na+). Denne positive ladning gør det meget reaktivt og tilbøjeligt til at danne ioniske bindinger med negativt ladede elementer.
* tendens til at danne ioner: På grund af dens reaktive natur og elektropositivitet danner natrium let ioniske bindinger med andre elementer, hvilket skaber salte. Disse salte er stabile og findes ofte i naturen.
* rigelig i Jordens skorpe: Natrium er det sjette mest rigelige element i jordens skorpe, men det findes næsten udelukkende i ionisk form inden for forskellige mineraler og klipper.
Eksempler på natriumforbindelser:
* natriumchlorid (NaCl) - bordsalt: Dette er den mest almindelige natriumforbindelse, der findes i naturen.
* natriumbicarbonat (NAHCO3) - Bagepulver: Brugt til bagning, rengøring og antacida.
* natriumnitrat (NANO3) - Brugt i gødning og eksplosiver.
I resumé gør natriums meget reaktive natur, dens tendens til at danne ioner og dens overflod i jordens skorpe det næsten umuligt at finde rent natrium i naturen. Det findes altid i forbindelser dannet gennem kemiske reaktioner med andre elementer.
Sidste artikelHvad er en glat forbindelse?
Næste artikelHar en mol klorgas en masse 35,45 gram.?
 Varme artikler
Varme artikler
-
 Udskrivning af komplekse cellulosebaserede objekterEn 3D-trykt ørebruskimitation lavet af cellulosekompositmaterialet. Kredit:Michael Hausmann / ETH Zürich / Empa Forskere fra ETH Zürich og de schweiziske føderale laboratorier for materialevidensk
Udskrivning af komplekse cellulosebaserede objekterEn 3D-trykt ørebruskimitation lavet af cellulosekompositmaterialet. Kredit:Michael Hausmann / ETH Zürich / Empa Forskere fra ETH Zürich og de schweiziske føderale laboratorier for materialevidensk -
 Forskere udvikler lovende ny type polymerLyse farver:SPPV -polymerer har mange vigtige teknologiske anvendelser. Kredit:TU Wien Organiske polymerer bruges i solceller, sensorer, LEDer og i mange andre enheder. En specifik type polymer, S
Forskere udvikler lovende ny type polymerLyse farver:SPPV -polymerer har mange vigtige teknologiske anvendelser. Kredit:TU Wien Organiske polymerer bruges i solceller, sensorer, LEDer og i mange andre enheder. En specifik type polymer, S -
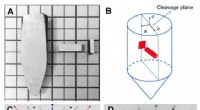 Høj termoelektrisk ydeevne i billige SnS0.91Se0.09-krystaller(A) En typisk krystal spaltet langs (100) planet, og prøve skåret langs b-aksen. (B) Et diagram viser, hvordan prøver skærer langs b-aksen til målinger. (C) Standard Laue diffraktionsbillede af SnS kr
Høj termoelektrisk ydeevne i billige SnS0.91Se0.09-krystaller(A) En typisk krystal spaltet langs (100) planet, og prøve skåret langs b-aksen. (B) Et diagram viser, hvordan prøver skærer langs b-aksen til målinger. (C) Standard Laue diffraktionsbillede af SnS kr -
 Video:Hvorfor lugter månen af krudt?Kredit:The American Chemical Society Efter at have gået på månen, astronauter hoppede tilbage i deres månelander, bringer himmellegemets støv med sig på deres rumdragter. De var overraskede, og f
Video:Hvorfor lugter månen af krudt?Kredit:The American Chemical Society Efter at have gået på månen, astronauter hoppede tilbage i deres månelander, bringer himmellegemets støv med sig på deres rumdragter. De var overraskede, og f
- Hvorfor ideen om, at engelsk har en fælles angelsaksisk oprindelse, er en myte
- Flying carpet-teknik bruger grafen til at levere en-to-punch af kræftmedicin
- Hvornår er et symmetrisk molekyle polært?
- Amerikanernes mistillid til institutioner og hinanden giver næring til kynismen. Er det hele dårli…
- Facebook lancerer en nyhedsafdeling - og betaler udgivere
- Kan soludbrud skade astronauter?


