Hvorfor nitrogen er gas, men fosfor er et fast stof?
* nitrogen (n 2 ): Kvælstof findes som en diatomisk gas (N 2 ) på grund af tredobbelt obligation mellem de to nitrogenatomer. Denne stærke tredobbelte binding skaber et meget stabilt molekyle med minimale intermolekylære kræfter. De eneste kræfter, der virker mellem nitrogenmolekyler, er svage van der Waals Forces , som let overvindes ved stuetemperatur, hvilket gør det muligt for nitrogen at eksistere som en gas.
* fosfor (p 4 ): Fosfor findes som en tetrahedral p 4 molekyle. Mens fosfor kan danne flere bindinger, er det mere almindeligt at finde det dannelse af enkeltobligationer med andre fosforatomer. Disse enkelt obligationer er svagere end den tredobbelte binding i nitrogen, hvilket fører til et mindre stabilt molekyle. intermolekylære kræfter mellem p 4 Molekyler er stærkere end dem mellem N 2 Molekyler på grund af den større størrelse og større polariserbarhed af fosforatomer. Disse stærkere intermolekylære kræfter er stærke nok til at holde p 4 Molekyler sammen i en fast struktur ved stuetemperatur.
Kortfattet:
* stærkere binding: Nitrogens tredobbelte binding skaber et meget stabilt molekyle med svage intermolekylære kræfter, så det kan eksistere som en gas.
* svagere binding: Fosfors enkeltbindinger og større størrelse fører til stærkere intermolekylære kræfter, hvilket resulterer i en fast tilstand.
Derudover muliggør den elektroniske konfiguration af fosfor dannelsen af mere komplekse strukturer i fast tilstand, hvilket yderligere bidrager til dens soliditet.
Sidste artikelEr svovlsyre en ionisk forbindelse?
Næste artikelHvor mange gram bariumbromid BABR2 er til stede i 3,56 mol denne forbindelse?
 Varme artikler
Varme artikler
-
 Hit-to-lead undersøgelser af en ny serie af små molekyle inhibitorer af DHODHKredit:CC0 Public Domain Enzymet dihydroorotate dehydrogenase (DHODH), en væsentlig komponent for de novo pyrimidin-ribonukleotid-biosyntese, er genopstået i de sidste par år som et mål for udvikl
Hit-to-lead undersøgelser af en ny serie af små molekyle inhibitorer af DHODHKredit:CC0 Public Domain Enzymet dihydroorotate dehydrogenase (DHODH), en væsentlig komponent for de novo pyrimidin-ribonukleotid-biosyntese, er genopstået i de sidste par år som et mål for udvikl -
 Forbedring af den elektromekaniske opførsel af en fleksibel polymerQiming Zhang, en fremtrædende professor i elektroteknik, førte et team af forskere til at udvikle et robust piezoelektrisk materiale, der kan omdanne mekanisk stress til elektricitet. Kredit:Tyler Hen
Forbedring af den elektromekaniske opførsel af en fleksibel polymerQiming Zhang, en fremtrædende professor i elektroteknik, førte et team af forskere til at udvikle et robust piezoelektrisk materiale, der kan omdanne mekanisk stress til elektricitet. Kredit:Tyler Hen -
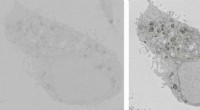 Smart trick muliggør 20 gange hurtigere billeddannelse med elektronmikroskopiTo billeder af en HeLa-celle, begge optaget på 33,6 sekunder. Billedet til højre blev taget, mens en spænding blev påført prøveholderen. Kredit:TU Delft Forskere ved Delft University of Technology
Smart trick muliggør 20 gange hurtigere billeddannelse med elektronmikroskopiTo billeder af en HeLa-celle, begge optaget på 33,6 sekunder. Billedet til højre blev taget, mens en spænding blev påført prøveholderen. Kredit:TU Delft Forskere ved Delft University of Technology -
 Forskere opdager nyt felt, der påvirker metals størkningVed test af krystallinske (røde) og flydende (grønne) materialer i et miljø uden støj - lydvibrationer eller forstyrrelser, der vides at virke på et størkende materiale - opdagede forskere ved Florida
Forskere opdager nyt felt, der påvirker metals størkningVed test af krystallinske (røde) og flydende (grønne) materialer i et miljø uden støj - lydvibrationer eller forstyrrelser, der vides at virke på et størkende materiale - opdagede forskere ved Florida
- Hvorfor er solkilden til energi til fossile brændstoffer?
- Navn 4 slags stødende klipper?
- Når man læser en lille huller, hvordan tages mikrometeret i forhold til delt kugle på eller 90 gr…
- Nærmer vi os mørkt stof?
- Optrævlende turbulens:Ny indsigt i, hvordan væsker forvandles fra orden til uorden
- Sådan laver du et magnetisk felt


