Er et metalopløseligt i vand?
Her er hvorfor:
* Metalliske obligationer: Metaller holdes sammen af stærke metalliske bindinger, som involverer et "hav" af delokaliserede elektroner. Disse obligationer er meget vanskelige at bryde.
* Polaritet: Vand er et polært molekyle, hvilket betyder, at det har en positiv og negativ ende. De fleste metaller er ikke polære, så de interagerer ikke godt med vandmolekyler.
* Undtagelser: Der er nogle få undtagelser fra denne regel. For eksempel:
* alkalimetaller (som natrium og kalium) reagerer voldsomt med vand. De opløses ikke i traditionel forstand, men de reagerer på dannelse af brintgas og et metalhydroxid.
* nogle metalioner kan opløses i vand. For eksempel opløses kobbersulfat i vand til dannelse af kobberioner (Cu2+) og sulfationer (SO42-).
Kortfattet: De fleste metaller er ikke opløselige i vand, fordi deres stærke metalliske bindinger og mangel på polaritet gør det vanskeligt for dem at interagere med vandmolekyler.
 Varme artikler
Varme artikler
-
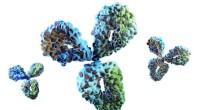 I et felt, hvor mindre er bedre, forskere opdager verdens mindste antistofferFuldstændig struktur af et antistof, viser dens domæner. Kredit:University of Bath Forskere ved University of Bath i Storbritannien og biofarmavirksomheden UCB har fundet en måde at producere mini
I et felt, hvor mindre er bedre, forskere opdager verdens mindste antistofferFuldstændig struktur af et antistof, viser dens domæner. Kredit:University of Bath Forskere ved University of Bath i Storbritannien og biofarmavirksomheden UCB har fundet en måde at producere mini -
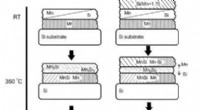 Fysikere overvåger dannelsen af film med højere mangansilicidSkematisk illustration af synteseproceduren til venstre:Mn17Si30 og højre Mn4Si7 -prøve. Kredit:Ivan Tarasov Et team fra Kirensky Institute of Physics (Siberian Branch of the Russian Academy of Sc
Fysikere overvåger dannelsen af film med højere mangansilicidSkematisk illustration af synteseproceduren til venstre:Mn17Si30 og højre Mn4Si7 -prøve. Kredit:Ivan Tarasov Et team fra Kirensky Institute of Physics (Siberian Branch of the Russian Academy of Sc -
 Forskere får kontrol over syntesen af bløde molekylerKemisk og biomolekylær ingeniørprofessor Damien Guironnet, ret, og kandidatstuderende Dylan Walsh udviklede en ny teknik, der giver dem mulighed for at programmere størrelsen, form og sammensætning af
Forskere får kontrol over syntesen af bløde molekylerKemisk og biomolekylær ingeniørprofessor Damien Guironnet, ret, og kandidatstuderende Dylan Walsh udviklede en ny teknik, der giver dem mulighed for at programmere størrelsen, form og sammensætning af -
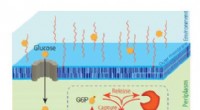 Opdagelse af nyt fænomen en game-changer for effektiv bioproduktion af nyttige kemikalierG6P-sekretionsmekanismen opdaget i denne undersøgelse. Kredit:Kobe University Et forskningssamarbejde har opdaget en ny mekanisme, hvorved glukose, der blev fanget af E. coli, derefter udskilles fr
Opdagelse af nyt fænomen en game-changer for effektiv bioproduktion af nyttige kemikalierG6P-sekretionsmekanismen opdaget i denne undersøgelse. Kredit:Kobe University Et forskningssamarbejde har opdaget en ny mekanisme, hvorved glukose, der blev fanget af E. coli, derefter udskilles fr


