Hvad er Lewis -strukturen i binding af natrium og klor?
Her er hvorfor:
* natrium Har en valenselektron og mister den let for at opnå en stabil oktetkonfiguration.
* klor Har syv valenselektroner og får let en elektron for at opnå en stabil octet -konfiguration.
Når natrium- og klorreaktioner, mister natrium sin valenselektron til klor og danner en natriumkation (Na+) og en chloridanion (CL-). Disse modsatte ladede ioner tiltrækkes derefter af hinanden via elektrostatiske kræfter og danner en ionisk binding.
I stedet for en Lewis -struktur repræsenterer vi den ioniske binding mellem natrium og klor ved hjælp af følgende notation:
Na + Cl → Na + + Cl-
Dannelsen af natriumchlorid (NaCl) er afbildet som:
[Na]+ [cl]-
Denne notation viser overførslen af et elektron fra natrium til klor og dannelsen af den ioniske forbindelse natriumchlorid.
 Varme artikler
Varme artikler
-
 Skoler med molekylær fisk kunne forbedre skærmeSkoler af solitons form til klynger. Kredit:Smalyukh lab Tag et dyk ned i det, der kan være verdens mindste koralrev. Forskere ved University of Colorado Boulder bruger en type materiale kaldet fl
Skoler med molekylær fisk kunne forbedre skærmeSkoler af solitons form til klynger. Kredit:Smalyukh lab Tag et dyk ned i det, der kan være verdens mindste koralrev. Forskere ved University of Colorado Boulder bruger en type materiale kaldet fl -
 Overfladeforbedret Raman-spektroskopimetode realiserer kvantitativ påvisning af kræftlægemidler i…Figur 1. Skematisk diagram af 3D-hotspot-matrixdannelse. Kredit:Zhou Guoliang Ved at bruge den krympesamlede flydende tredimensionelle (3D) hot spot matrix som en mikroreaktor, blev en ny metode ti
Overfladeforbedret Raman-spektroskopimetode realiserer kvantitativ påvisning af kræftlægemidler i…Figur 1. Skematisk diagram af 3D-hotspot-matrixdannelse. Kredit:Zhou Guoliang Ved at bruge den krympesamlede flydende tredimensionelle (3D) hot spot matrix som en mikroreaktor, blev en ny metode ti -
 At bryde formen:Et usædvanligt materialevalg giver utroligt langtidsholdbare batterierSilica, en af de mest udbredte metaloxider, er lavpris, let at behandle, og kunne blive en nøglekomponent i næste generations genopladelige batterier. Kredit:DGIST Den enorme stigning i brugen a
At bryde formen:Et usædvanligt materialevalg giver utroligt langtidsholdbare batterierSilica, en af de mest udbredte metaloxider, er lavpris, let at behandle, og kunne blive en nøglekomponent i næste generations genopladelige batterier. Kredit:DGIST Den enorme stigning i brugen a -
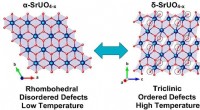 Brug af uran til at skabe orden fra uordenKredit:Australian Nuclear Science and Technology Organization (ANSTO) ANSTOs unikke skelsættende infrastruktur er blevet brugt til at undersøge uran, nøglen til atombrændstofcyklussen. De avancere
Brug af uran til at skabe orden fra uordenKredit:Australian Nuclear Science and Technology Organization (ANSTO) ANSTOs unikke skelsættende infrastruktur er blevet brugt til at undersøge uran, nøglen til atombrændstofcyklussen. De avancere
- Hvilken type binding dannes mellem kobber og fluor?
- Hvad er mere inerti Månen eller solen?
- Livslevn i den Mars-meteorit? Et frisk look
- Hvad er BPA, og hvorfor er det i så mange plastikprodukter?
- Ny biokatalytisk membran fjerner mikroforurenende stoffer på en effektiv og stabil måde
- Hvorfor lederes forsøg på at styrke deres medarbejdere ofte mislykkes – og endda fører til uetisk…


