Na2O er ikke en molekylær formel hvorfor?
* ioniske forbindelser: Na₂o repræsenterer natriumoxid, en ionisk forbindelse. Ioniske forbindelser dannes af den elektrostatiske tiltrækning mellem positivt ladede ioner (kationer) og negativt ladede ioner (anioner).
* Ingen diskrete molekyler: I ioniske forbindelser er der ingen diskrete molekyler, som du finder i kovalente forbindelser. I stedet er der en kæmpe gitterstruktur, hvor hver natriumion (Na⁺) er omgivet af flere oxidioner (O²⁻), og vice versa.
* Empirisk formel: Na₂o er den empiriske formel til natriumoxid. Den empiriske formel viser det enkleste forhold mellem hele nummeret for atomer i en forbindelse.
I modsætning hertil er en molekylær formel:
* Repræsenterer det faktiske antal atomer for hvert element i et enkelt molekyle.
* Gælder for kovalente forbindelser, hvor atomer deler elektroner til dannelse af diskrete molekyler.
Eksempel:
* molekylær formel: H₂O (vand) repræsenterer et enkelt molekyle vand med 2 hydrogenatomer og 1 iltatom.
* Empirisk formel: H₂O (vand) er også den empiriske formel, fordi det er det enkleste forhold mellem hele nummeret for atomer i vand.
Fortæl mig, hvis du gerne vil have flere detaljer om ioniske vs. kovalente forbindelser!
 Varme artikler
Varme artikler
-
 Nyudviklet is-afstødende belægning er 100 gange stærkere end andreKredit:Unsplash/CC0 Public Domain En maskiningeniør fra University of Houston har udviklet et sprøjtbart is-udskillende materiale, der er 100 gange stærkere end noget andet. Det nye holdbare belægn
Nyudviklet is-afstødende belægning er 100 gange stærkere end andreKredit:Unsplash/CC0 Public Domain En maskiningeniør fra University of Houston har udviklet et sprøjtbart is-udskillende materiale, der er 100 gange stærkere end noget andet. Det nye holdbare belægn -
 Udskrivning lille, højpræcisionsobjekter på få sekunderForskere ved EPFL har udviklet en ny, højpræcisionsmetode til 3D-print små, bløde genstande. Processen, som tager mindre end 30 sekunder fra start til slut, har potentielle anvendelser inden for en br
Udskrivning lille, højpræcisionsobjekter på få sekunderForskere ved EPFL har udviklet en ny, højpræcisionsmetode til 3D-print små, bløde genstande. Processen, som tager mindre end 30 sekunder fra start til slut, har potentielle anvendelser inden for en br -
 Brændstof ud af den blå luft:Ny vej til opsamling og opgradering af CO2Geonhui Lee, Ph.d. -kandidat, driver en elektrolysator, der er i stand til at omdanne opløst carbonat til CO2 og derefter til syngas. Enheden tilbyder en ny, kortere vej til omdannelse af atmosfærisk
Brændstof ud af den blå luft:Ny vej til opsamling og opgradering af CO2Geonhui Lee, Ph.d. -kandidat, driver en elektrolysator, der er i stand til at omdanne opløst carbonat til CO2 og derefter til syngas. Enheden tilbyder en ny, kortere vej til omdannelse af atmosfærisk -
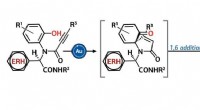 Kemiker udvikler syntesemetode for 28 biologisk aktive molekylerKredit:RUDN Universitet RUDN Universitetskemiker Erik Van der Eycken har fundet frem til en ny metode til syntese af en stor gruppe komplekse poly-heterocykliske organiske forbindelser, som kan ha
Kemiker udvikler syntesemetode for 28 biologisk aktive molekylerKredit:RUDN Universitet RUDN Universitetskemiker Erik Van der Eycken har fundet frem til en ny metode til syntese af en stor gruppe komplekse poly-heterocykliske organiske forbindelser, som kan ha
- En mere sikker måde at fremstille azider til brug i klikkemi
- Hoppende vanddråber afslører småskala skønhed (m/ video)
- Cu2 Plus har hvor mange protroner og elektroner?
- Er en af månerne måne?
- Platinfri katalysatorer kunne lave billigere brintbrændselsceller
- Doppler-effekt: Definition, ligning & eksempel


