Hvor hydrogenbindinger tillader vand at fungere som et opløsningsmiddel opløses natriumchlorid?
1. Polaritet af vand:
* Vandmolekyler (H₂O) er polar . Dette betyder, at de har en lidt positiv ladning på brintsiden og en lidt negativ ladning på iltsiden.
* Denne polaritet opstår, fordi ilt er mere elektronegativ end brint, hvilket tiltrækker de delte elektroner stærkere.
2. Ionisk natur af natriumchlorid:
* Natriumchlorid er en ionisk forbindelse sammensat af positivt ladede natriumioner (Na⁺) og negativt ladede chloridioner (CL⁻).
* Disse ioner holdes sammen af stærke elektrostatiske attraktioner (ioniske bindinger).
3. Opløsningsprocessen:
* Når natriumchlorid tilsættes til vand, omgiver de polære vandmolekyler ionerne.
* lidt positiv Hydrogenender af vandmolekyler tiltrækkes af negativt ladede Chloridioner (Cl⁻).
* lidt negativ Oxygenender af vandmolekyler tiltrækkes af positivt ladede Natriumioner (Na⁺).
* Disse attraktioner kaldes ion-dipol-interaktioner .
* Disse interaktioner er stærke nok til at overvinde de elektrostatiske kræfter, der holder natrium- og chloridioner sammen i krystalgitteret.
* Vandmolekylerne trækker effektivt ionerne fra hinanden, bryder de ioniske bindinger og får saltet til at opløses.
I det væsentlige:
Den polære natur af vandmolekyler, med deres evne til at danne brintbindinger, giver dem mulighed for at interagere stærkt med ionerne i natriumchlorid, forstyrre det ioniske gitter og opløste saltet.
Nøglepunkter:
* Hydrogenbinding er ikke direkte involveret i at opløse NaCl. Det er polariteten af vand og de resulterende ion-dipol-interaktioner, der er afgørende.
* Vandets evne til at fungere som et opløsningsmiddel for ioniske forbindelser som NaCI er et resultat af dets polaritet.
* Processen med at opløse natriumchlorid er et eksempel på solvation , hvor opløsningsmiddelmolekyler omgiver og separate opløste partikler.
 Varme artikler
Varme artikler
-
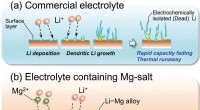 Forskere tager skridt mod sikrere batterier ved at trimme litiumgreneSkematisk illustration af den foreslåede undertrykkende effekt af Li dendritisk vækst ved tilsætning af Mg-salt. Kredit:Royal Society of Chemistry Et samarbejdende team af forskere fra Shinshu Uni
Forskere tager skridt mod sikrere batterier ved at trimme litiumgreneSkematisk illustration af den foreslåede undertrykkende effekt af Li dendritisk vækst ved tilsætning af Mg-salt. Kredit:Royal Society of Chemistry Et samarbejdende team af forskere fra Shinshu Uni -
 Uldlignende materiale kan huske og ændre formEt keratinark foldet til en kompleks origamistjerne som sin permanente form. Kredit:Luca Cera/Harvard SEAS Som enhver, der nogensinde har glattet deres hår, ved, vand er fjenden. Hår, der omhyggel
Uldlignende materiale kan huske og ændre formEt keratinark foldet til en kompleks origamistjerne som sin permanente form. Kredit:Luca Cera/Harvard SEAS Som enhver, der nogensinde har glattet deres hår, ved, vand er fjenden. Hår, der omhyggel -
 Fremtiden ser lys ud for uendeligt genanvendeligt plastikBrett Helms, forgrunden, afbilledet på arbejde i Molecular Foundry i 2019. Kredit:Thor Swift/Berkeley Lab Plast er en del af næsten alle produkter, vi bruger til daglig. Den gennemsnitlige person
Fremtiden ser lys ud for uendeligt genanvendeligt plastikBrett Helms, forgrunden, afbilledet på arbejde i Molecular Foundry i 2019. Kredit:Thor Swift/Berkeley Lab Plast er en del af næsten alle produkter, vi bruger til daglig. Den gennemsnitlige person -
 En katalysator, der ødelægger perklorat i vand, kan rense MarsjordKredit:CC0 Public Domain Ateam ledet af UC Riverside-ingeniører har udviklet en katalysator til at fjerne et farligt kemikalie fra vand på Jorden, der også kan gøre Marsjord mere sikker for landbr
En katalysator, der ødelægger perklorat i vand, kan rense MarsjordKredit:CC0 Public Domain Ateam ledet af UC Riverside-ingeniører har udviklet en katalysator til at fjerne et farligt kemikalie fra vand på Jorden, der også kan gøre Marsjord mere sikker for landbr
- Hvad er funktionen af alkalisk i menneskekroppen?
- Hvad er indre dræningsbassin?
- Skorpebevægelser og belastningshastigheder i den sydlige Basin and Range-provins
- Facebook, Google og Amazon for store? Hvorfor det spørgsmål bliver ved med at dukke op
- Hvorfor er vandcyklussen vigtig for mennesker og planter?
- Hvilken type stof er natriumhydroxid?


