Hvor mange valenselektroner skal nitrogen være fulde?
Her er hvorfor:
* nitrogen's atomstruktur: Nitrogen har 7 elektroner. Dens elektroniske konfiguration er 1S² 2s² 2p³.
* Valenselektroner: Valenselektroner er elektronerne i den yderste skal, der er involveret i binding. Nitrogens valenselektroner er i 2. skal (2S² 2p³), hvilket i alt 5.
* octet regel: Atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en stabil konfiguration af 8 valenselektroner (Octet -regel), svarende til en ædel gas.
* Nitrogen's behov: Nitrogen har brug for 3 flere elektroner for at afslutte sin oktet. Det kan opnå dette ved at danne kovalente bindinger med andre atomer og dele elektroner.
Sidste artikelHvilken type alkali bruges til at ætse glas?
Næste artikelHvilken gas opløses i surt regn, der får den til at være sur?
 Varme artikler
Varme artikler
-
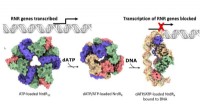 Ny mekanisme til regulering af forsyningen af DNA-byggesten til bedre antibiotikaVirkningsmekanismen af den RNR-specifikke repressor NrdR. Overfladerepræsentation af cryo-EM-kortene for de dodecameriske, oktamere og DNA-bundne tetramere NrdR-strukturer. NrdR-monomerer i hver tet
Ny mekanisme til regulering af forsyningen af DNA-byggesten til bedre antibiotikaVirkningsmekanismen af den RNR-specifikke repressor NrdR. Overfladerepræsentation af cryo-EM-kortene for de dodecameriske, oktamere og DNA-bundne tetramere NrdR-strukturer. NrdR-monomerer i hver tet -
 Ny metode eliminerer interferens af nikotin ved påvisning af metamfetaminIonmobilitetsspektre for metamfetamin, nikotin, og deres blanding uden (venstre) og med dopet pyridin (højre). Kredit:XIA Lei For nylig, en forskergruppe ledet af Chu Yannan og Huang Chaoqun fra I
Ny metode eliminerer interferens af nikotin ved påvisning af metamfetaminIonmobilitetsspektre for metamfetamin, nikotin, og deres blanding uden (venstre) og med dopet pyridin (højre). Kredit:XIA Lei For nylig, en forskergruppe ledet af Chu Yannan og Huang Chaoqun fra I -
 Hvordan nobelvindende kemikere brugte og styrede evolutionenDe amerikanske videnskabsmænd Frances Arnold og George Smith og den britiske forsker Gregory Winter har vundet Nobelprisen i kemi 2018 Tre videnskabsmænd delte onsdag Nobel Kemiprisen 2018 for der
Hvordan nobelvindende kemikere brugte og styrede evolutionenDe amerikanske videnskabsmænd Frances Arnold og George Smith og den britiske forsker Gregory Winter har vundet Nobelprisen i kemi 2018 Tre videnskabsmænd delte onsdag Nobel Kemiprisen 2018 for der -
 Farveskiftende gnisterKredit:Clausthal University of Technology Gnister er et fascinerende fænomen, der er kendt fra lejrbål, flintsten og elektriske stjernekast og andre pyrotekniske artikler. Når man ser nærmere på g
Farveskiftende gnisterKredit:Clausthal University of Technology Gnister er et fascinerende fænomen, der er kendt fra lejrbål, flintsten og elektriske stjernekast og andre pyrotekniske artikler. Når man ser nærmere på g


