Hvordan er D-Block-gruppenummeret til af de ydre S- og D-elektroner?
Forståelse af D-blokken
* placering: D-blokke-elementerne findes i grupper 3-12 i den periodiske tabel.
* Elektronkonfiguration: De har deres yderste elektroner i d orbitaler (deraf navnet "D-blok").
* påfyldningsmønster: D orbitaler udfylder et specifikt mønster, og antallet af D -elektroner bestemmer gruppenummeret.
forholdet
* yderste S elektroner: D-blokke-elementerne har typisk to Elektroner i deres yderste s orbital (NS).
* Gruppenummer: Gruppenummeret svarer til samlede antal ydre S- og D -elektroner .
Eksempel:
* gruppe 5: Et gruppe 5-element har en konfiguration som (n-1) d⁵ ns².
* Det har 5 d elektroner og 2 s elektroner, hvilket gør i alt 7 ydre elektroner.
Vigtige noter:
* Undtagelser: Nogle D-blokelementer har usædvanlige elektronkonfigurationer på grund af stabiliteten af halvfyldte og fuldt fyldte D-orbitaler. Dette kan føre til lette afvigelser fra det generelle mønster.
* Overgangsmetaller: D-blokke-elementerne omtales ofte som "overgangsmetaller", fordi de udviser variable valenser og danner en lang række forbindelser.
Kortfattet:
Gruppenummeret i D-blokken er en direkte afspejling af det samlede antal elektroner i de yderste S og D-orbitaler.
 Varme artikler
Varme artikler
-
 Nær-infrarøde reflekterende blandingsbelægninger har bedre optisk og køleydelseKredit:DOI:10.1016/j.solener.2021.06.061 Kinesiske forskere fandt for nylig, at en nær-infrarød reflekterende blandingscoating havde bedre optisk og køleydelse, derved reducerer den absorberede en
Nær-infrarøde reflekterende blandingsbelægninger har bedre optisk og køleydelseKredit:DOI:10.1016/j.solener.2021.06.061 Kinesiske forskere fandt for nylig, at en nær-infrarød reflekterende blandingscoating havde bedre optisk og køleydelse, derved reducerer den absorberede en -
 Forskere kaster lys over nyt billigt materiale til at se i mørketDr. Wendy Sarney bruger den molekylære stråleepitaximaskine ved US Army Research Laboratory til at producere infrarøde detektormaterialer med en ny synteseproces. Kredit:US Army Forskere ved U.S.
Forskere kaster lys over nyt billigt materiale til at se i mørketDr. Wendy Sarney bruger den molekylære stråleepitaximaskine ved US Army Research Laboratory til at producere infrarøde detektormaterialer med en ny synteseproces. Kredit:US Army Forskere ved U.S. -
 Forskerhold dechifrerer enzymatisk nedbrydning af sukker fra marine algerEnzymer er biokatalysatorer, der er afgørende for nedbrydningen af tangbiomasse i havene. For første gang, et internationalt hold af 19 forskere afkodede for nylig den komplette nedbrydningsvej for
Forskerhold dechifrerer enzymatisk nedbrydning af sukker fra marine algerEnzymer er biokatalysatorer, der er afgørende for nedbrydningen af tangbiomasse i havene. For første gang, et internationalt hold af 19 forskere afkodede for nylig den komplette nedbrydningsvej for -
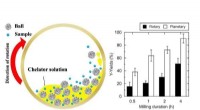 Forkortelse af sjældne jordarters forsyningskæde via genbrugFigur Skematisk afbildning af den chelator-assisteret våd-fræsning i en kuglemølle, og sammenligning af Y-udbyttet (procent) fra EoL-FL i roterende og planetariske kuglemøller. Kredit:Kanazawa Univers
Forkortelse af sjældne jordarters forsyningskæde via genbrugFigur Skematisk afbildning af den chelator-assisteret våd-fræsning i en kuglemølle, og sammenligning af Y-udbyttet (procent) fra EoL-FL i roterende og planetariske kuglemøller. Kredit:Kanazawa Univers
- Hvad betyder invasionen af Ukraine for IPCC's seneste klimaændringsrapport
- Californiens regntid er her. Hvad betyder det for vandforsyningen?
- Hvad er temperaturen på en sort dværgstjerne?
- Undersøgelse viser, hvordan man kan forbedre håndteringen af kommunalt fast affald
- Hvilket produkt producerer hydrogenperoxid vand luminol ammoniumcarbonat natrium kobbersulfat pentah…
- Hvor dårlig forvaltning af nigerianske skove førte til udnyttelse af kriminelle


