Hvorfor binder nitrogen ikke mere end 4 andre atomer?
1. Elektronisk konfiguration: Nitrogen har fem valenselektroner (elektroner i den yderste skal). For at opnå en stabil octet skal den få yderligere tre elektroner. Dette kan opnås ved at dele elektroner med andre atomer.
2. Valence Shell Electron Pair Repulsion (VSEPR) Teori: VSEPR -teori siger, at elektronparker omkring et centralt atom afviser hinanden og forsøger at maksimere deres afstand. Når nitrogen danner fire bindinger, arrangeres elektronparene i en tetrahedral geometri, der minimerer frastødelse.
3. Sterisk hindring: Mens nitrogen teknisk kan rumme fem obligationer, ville den femte binding være markant svagere på grund af sterisk hindring. Dette skyldes, at de fire bindinger allerede skaber et overfyldt miljø omkring nitrogenatomet, hvilket gør det vanskeligt for et femte atom at nærme sig og danne en stabil binding.
4. Energiovervejelser: At danne mere end fire bindinger ville kræve, at nitrogenatomet besætter orbitaler med højere energi. Dette ville være energisk ugunstigt og sandsynligvis føre til et mindre stabilt molekyle.
Undtagelser:
Der er nogle få undtagelser, hvor nitrogen danner mere end fire obligationer, men disse er sjældne og kræver specifikke betingelser:
* hypervalente forbindelser: I visse forbindelser med stærkt elektronegative atomer bundet til nitrogen kan nitrogenatomet midlertidigt udvide sin oktet og danne fem bindinger.
* usædvanlige bindingsscenarier: Nogle eksotiske molekyler kan udvise usædvanlige bindingsarrangementer, hvor nitrogen kan have mere end fire bindinger på grund af ukonventionel elektrondeling.
Konklusion:
Kombinationen af dens elektroniske konfiguration, VSEPR -teori, sterisk hindring og energiovervejelser forklarer, hvorfor nitrogen typisk danner maksimalt fire bindinger. Mens der er undtagelser, er disse relativt usædvanlige.
Sidste artikelHvordan finder du formlen for kobber 2 -fosfat?
Næste artikelHvad er ligningen for reaktion af svovlsyre og natriumhydroxid?
 Varme artikler
Varme artikler
-
 Maskinlæring forbinder materialesammensætning og ydeevne i katalysatorerKredit:University of Michigan I et fund, der kunne være med til at bane vejen mod renere brændstoffer og en mere bæredygtig kemisk industri, forskere ved University of Michigan har brugt maskinlær
Maskinlæring forbinder materialesammensætning og ydeevne i katalysatorerKredit:University of Michigan I et fund, der kunne være med til at bane vejen mod renere brændstoffer og en mere bæredygtig kemisk industri, forskere ved University of Michigan har brugt maskinlær -
 Omdannelse af fibriller til krystallerTændstik-lignende amyloidkrystaller kunne repræsentere den mest stabile foldede struktur af et protein eller en lang peptidsekvens. Kredit:Reynolds et al., Nat. Comm. 2017 Et internationalt team a
Omdannelse af fibriller til krystallerTændstik-lignende amyloidkrystaller kunne repræsentere den mest stabile foldede struktur af et protein eller en lang peptidsekvens. Kredit:Reynolds et al., Nat. Comm. 2017 Et internationalt team a -
 Succesfuld syntese af nanomateriale, der forbedrer katalysatorens effektivitet(Venstre mod højre) Dr. Md Shahriar Hossain, Prof Yusuke Yamauchi og Dr. Katy Wood ved Quokka-instrumentet. Kredit:Australian Nuclear Science and Technology Organisation (ANSTO) Et stort internati
Succesfuld syntese af nanomateriale, der forbedrer katalysatorens effektivitet(Venstre mod højre) Dr. Md Shahriar Hossain, Prof Yusuke Yamauchi og Dr. Katy Wood ved Quokka-instrumentet. Kredit:Australian Nuclear Science and Technology Organisation (ANSTO) Et stort internati -
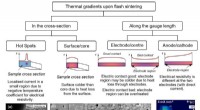 Solid-state-batterier kunne gøres mere rent ved at opskalere flash-sintringÅrsager og virkninger af termiske og mikrostrukturelle gradienter i flash sintret keramik. Kredit:WMG, University of Warwick Flash sintring er en keramisk behandlingsteknik, der bruger elektrisk s
Solid-state-batterier kunne gøres mere rent ved at opskalere flash-sintringÅrsager og virkninger af termiske og mikrostrukturelle gradienter i flash sintret keramik. Kredit:WMG, University of Warwick Flash sintring er en keramisk behandlingsteknik, der bruger elektrisk s
- Eksperimentel mini-accelerator opnår rekord energi
- Hvad er hysteresekurve?
- Hvad er forskellen mellem hastighed og acceleration?
- Hvilken er en sammensat jodvandluft eller calicum?
- Hurds Oracle-koncert:Er Ellison frynsegoder eller problem?
- Hvad er de største forskelle mellem planteceller og dyreceller?


