Hvad er konduktiviteten af kaliumiodid?
Her er hvorfor:
* ionisk natur: Ki er sammensat af en kaliumkation (K+) og en iodidanion (I-).
* dissociation i vand: Når Ki opløses i vand, overvinder den stærke elektrostatiske tiltrækning mellem vandmolekylerne og ionerne den ioniske binding, der holder Ki -molekylet sammen. Ionerne bliver omgivet af vandmolekyler og separate, hvilket skaber en opløsning med frit bevægelige ladningsselskaber (ioner).
* opladningsbærere: Disse frie ioner kan bære elektrisk strøm, hvilket gør opløsningen meget ledende.
Kvantitative værdier for ledningsevne afhænger af koncentrationen af opløsningen og temperaturen.
Her er en generel sammenligning:
* rent vand: Meget lav ledningsevne på grund af den begrænsede tilstedeværelse af H+ og OH-ioner.
* fortyndet ki -løsning: Høj ledningsevne sammenlignet med rent vand.
* koncentreret KI -løsning: Endnu højere ledningsevne på grund af flere ioner pr. Enhedsvolumen.
Bemærk: Konduktivitet er ikke den samme som opløselighed. Mens KI er meget opløselig i vand, er dens ledningsevne en separat egenskab relateret til dens ioner til at bære elektrisk strøm.
 Varme artikler
Varme artikler
-
 At finde nyt liv til vin-drue-resterKredit:CC0 Public Domain Californien producerer næsten 4 millioner tons vin i verdensklasse hvert år, men med det kommer tusindvis af tons af rester som drueskind, frø, stængler og frugtkød. Hvad
At finde nyt liv til vin-drue-resterKredit:CC0 Public Domain Californien producerer næsten 4 millioner tons vin i verdensklasse hvert år, men med det kommer tusindvis af tons af rester som drueskind, frø, stængler og frugtkød. Hvad -
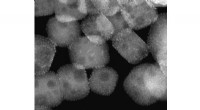 Forvandling af plastikaffald til smøreolieElektronmikrofotografi af platinnanopartiklerne fordelt på perovskit nanorør. Kredit:Northwestern University/Argonne National Laboratory/Ames Laboratory Engangsplast kan have mere iboende værdi, e
Forvandling af plastikaffald til smøreolieElektronmikrofotografi af platinnanopartiklerne fordelt på perovskit nanorør. Kredit:Northwestern University/Argonne National Laboratory/Ames Laboratory Engangsplast kan have mere iboende værdi, e -
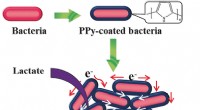 Ledende skal for bakterierKredit:Wiley Under anaerobe forhold, visse bakterier kan producere elektricitet. Denne adfærd kan udnyttes i mikrobielle brændselsceller, med særligt fokus på spildevandsbehandlingsordninger. Et s
Ledende skal for bakterierKredit:Wiley Under anaerobe forhold, visse bakterier kan producere elektricitet. Denne adfærd kan udnyttes i mikrobielle brændselsceller, med særligt fokus på spildevandsbehandlingsordninger. Et s -
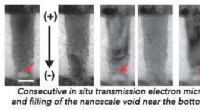 Forskere udvikler faseændringshukommelsesenheder til mere kraftfuld computingEt samarbejde mellem laboratoriet af Judy Cha, Carol og Douglas Melamed adjunkt i maskinteknik og materialevidenskab, og IBMs Watson Research Center kunne hjælpe med at gøre en potentielt revolutioner
Forskere udvikler faseændringshukommelsesenheder til mere kraftfuld computingEt samarbejde mellem laboratoriet af Judy Cha, Carol og Douglas Melamed adjunkt i maskinteknik og materialevidenskab, og IBMs Watson Research Center kunne hjælpe med at gøre en potentielt revolutioner
- Malawi landbrugseksperiment viser, hvordan enkle ændringer kan øge majsudbyttet og forbedre jorden…
- Kan bakterier i din tarm sende dig ind i depression?
- Hvad er kilden til energi, der driver vind og strømmende vand?
- Hvad er forholdet mellem køer og dekomponere?
- Hvor er der mest arktiske myg i Grønland og hvorfor?
- Nanopartikler kan rejse fra lunger til blod, muligvis forklare risici til hjertet


