Hvorfor er smeltepunktet for diamant højere end svovl?
diamant:
* stærk kovalent binding: Diamond har en kæmpe kovalent struktur, hvor hvert carbonatom er bundet til fire andre carbonatomer i et tetrahedralt arrangement. Disse stærke kovalente bindinger kræver en masse energi til at bryde, hvilket fører til et meget højt smeltepunkt (ca. 3550 ° C).
* Tredimensionelt netværk: De kovalente obligationer strækker sig i et kontinuerligt tredimensionelt netværk gennem hele diamantstrukturen. Dette stive netværk gør Diamond ekstremt hårdt og modstandsdygtigt over for deformation.
svovl:
* svage intermolekylære kræfter: Svovl findes i forskellige allotropiske former, hvor det mest almindelige er S8, hvor otte svovlatomer danner en ring. Bindingerne i S8 -ringen er kovalente, men ringene holdes sammen af svage van der Waals -styrker.
* molekylær struktur: Den molekylære struktur af svovl er relativt enkel med begrænsede intermolekylære interaktioner. Dette gør det nemt at bryde de intermolekylære kræfter, hvilket resulterer i et meget lavere smeltepunkt (ca. 115 ° C).
Kortfattet:
* stærkere obligationer: Diamonds stærke kovalente bindinger kræver meget mere energi at bryde end de svage intermolekylære kræfter i svovl.
* Tredimensionel struktur: Diamonds stive, tredimensionelle netværk gør det ekstremt modstandsdygtigt over for smeltning sammenlignet med svovlens molekylstruktur.
Denne forskel i binding og struktur forklarer den enorme forskel i smeltepunkter mellem diamant og svovl.
Sidste artikelHvad betyder abiotisk syntese?
Næste artikelEr sukkerkrystaller en blandingsløsningssammensætning eller et element?
 Varme artikler
Varme artikler
-
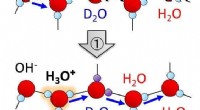 Unikke strukturelle udsving ved isoverfladen fremmer autoionisering af vandmolekylerSkematisk illustration af H/D isotopudvekslingsproces af vandmolekyler induceret af autoionisering og efterfølgende protonoverførsel. Kredit:NINS/IMS Vandis er et af de mest forekommende faste sto
Unikke strukturelle udsving ved isoverfladen fremmer autoionisering af vandmolekylerSkematisk illustration af H/D isotopudvekslingsproces af vandmolekyler induceret af autoionisering og efterfølgende protonoverførsel. Kredit:NINS/IMS Vandis er et af de mest forekommende faste sto -
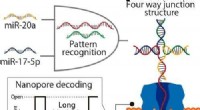 Nanopore-teknologi med DNA-beregning registrerer let mikroRNA-mønstre af lungekræftDNAer genkendte autonomt to mikroRNAer, miR-20a og miR-17-5p, og dannede en fire-vejs forbindelsesstruktur, der blev fanget i nanopore, viser lange blokeringsstrømme. Kredit:Figur tilpasset med tillad
Nanopore-teknologi med DNA-beregning registrerer let mikroRNA-mønstre af lungekræftDNAer genkendte autonomt to mikroRNAer, miR-20a og miR-17-5p, og dannede en fire-vejs forbindelsesstruktur, der blev fanget i nanopore, viser lange blokeringsstrømme. Kredit:Figur tilpasset med tillad -
 Ny indsigt i, hvordan cyanobakterier regulerer zinkoptagelsen i det åbne havKredit:Claudia Blindauer et al. Marine cyanobakterier (blågrønne alger) er væsentlige bidragsydere til det globale kulstofkredsløb og er grundlaget for fødenettet i mange af verdenshavene. De kræve
Ny indsigt i, hvordan cyanobakterier regulerer zinkoptagelsen i det åbne havKredit:Claudia Blindauer et al. Marine cyanobakterier (blågrønne alger) er væsentlige bidragsydere til det globale kulstofkredsløb og er grundlaget for fødenettet i mange af verdenshavene. De kræve -
 Specifikke ioneffekter rettet ædelmetal aerogelerAnalyse af den overordnede geleringsproces af guld -NPer. (A) Digitale fotos af gelforberedelsesprocessen. (B) Skematisk demonstration af geleringsprocessen og en tilsvarende kraftanalyse. (C) gradien
Specifikke ioneffekter rettet ædelmetal aerogelerAnalyse af den overordnede geleringsproces af guld -NPer. (A) Digitale fotos af gelforberedelsesprocessen. (B) Skematisk demonstration af geleringsprocessen og en tilsvarende kraftanalyse. (C) gradien
- Beskriv to måder, som radioaktive isotoper bruges i biomedicinsk forskning?
- Queens kvarter på vagt over for Amazon, der kommer til byen
- Hvad er formlen for merkurøst chlorid?
- Hvilken type energikilde er vandkraft?
- Hvad er landdækslet omkring Laurentian -bjerge?
- Hæve mindstelønnen? Undersøgelse ved hjælp af amerikanske skattedata finder mere gevinst end sme…


