En flaske kommerciel koncentreret vandig ammoniak er mærket 28,89 procent NH3 af masse og densitet 0,8960 gram ml. Hvad molaritetsløsningen?
1. Forstå de givne oplysninger:
* Procent efter masse: 28,89% NH3 betyder, at 100 g af opløsningen indeholder 28,89 g NH3.
* densitet: 0,8960 g/ml betyder, at 1 ml af opløsningen har en masse på 0,8960 g.
2. Beregn den molære masse af ammoniak (NH3):
* N (nitrogen) =14,01 g/mol
* H (brint) =1,01 g/mol
* Molmasse af NH3 =14,01 + (3 * 1,01) =17,04 g/mol
3. Bestem massen af ammoniak i 1 liter opløsning:
* Da densiteten er i g/ml, skal du konvertere 1 l til ml:1 l =1000 ml
* Masse af 1 L opløsning =(0,8960 g/ml) * (1000 ml) =896 g
* Mass af NH3 i 1 L opløsning =(28,89/100) * 896 g =259,3 g
4. Beregn antallet af mol ammoniak:
* Mol NH3 =(Mass of NH3) / (Molær masse af NH3)
* Mol NH3 =259,3 g / 17,04 g / mol =15,22 mol
5. Beregn molariteten:
* Molaritet (m) =(mol opløst stof) / (mængden af opløsning i liter)
* Molaritet =15,22 mol / 1 l =15,22 m
Derfor er molariteten af den koncentrerede ammoniakopløsning 15,22 m.
Sidste artikelHvorfor krystalliseres kobbersulfatopløsning?
Næste artikelHvad kalder du salte lavet af kalium og jod?
 Varme artikler
Varme artikler
-
 Lindring af antibiotikaresistens:Forskere tager skridt mod ny behandling af E. coliPhilip Hardwidge, professor i diagnostisk medicin og patobiologi ved Kansas State Universitys College of Veterinary Medicine, ret, og Samir El Qaidi, postdoc forsker, forsker i nye måder at behandle E
Lindring af antibiotikaresistens:Forskere tager skridt mod ny behandling af E. coliPhilip Hardwidge, professor i diagnostisk medicin og patobiologi ved Kansas State Universitys College of Veterinary Medicine, ret, og Samir El Qaidi, postdoc forsker, forsker i nye måder at behandle E -
 Mineaffald kunne bruges som ingrediens til billigere brintbrændstofproduktionPulveriseret feltspat. Kredit:Dr. Hong Peng Forskere har opdaget en måde at bruge minedriftsaffald som en del af en potentiel billigere katalysator til produktion af brintbrændstof. Vandsplittend
Mineaffald kunne bruges som ingrediens til billigere brintbrændstofproduktionPulveriseret feltspat. Kredit:Dr. Hong Peng Forskere har opdaget en måde at bruge minedriftsaffald som en del af en potentiel billigere katalysator til produktion af brintbrændstof. Vandsplittend -
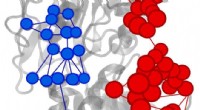 Kemikere finder et nyt værktøj til at forstå enzymer – GoogleEffektorudløst stigning (rød) eller reduktion (blå) af informationsstrømmen i IGPS-enzym. Kredit:Uriel Morzan Yale-forskere har taget en ny tilgang til at optrevle den komplekse struktur og regule
Kemikere finder et nyt værktøj til at forstå enzymer – GoogleEffektorudløst stigning (rød) eller reduktion (blå) af informationsstrømmen i IGPS-enzym. Kredit:Uriel Morzan Yale-forskere har taget en ny tilgang til at optrevle den komplekse struktur og regule -
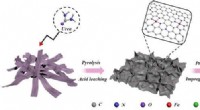 Forskere foreslår nye bifunktionelle katalysatorer på biomasse-afledt kulstofSkematisk illustration til syntesen af Fe 1 Pt 1 /NC. Kredit:CAO Lijuan Miljøvenlige energiomdannelsesteknologier, såsom brændselsceller og vandopdelingssystemer, har tiltrukket sig stor opm
Forskere foreslår nye bifunktionelle katalysatorer på biomasse-afledt kulstofSkematisk illustration til syntesen af Fe 1 Pt 1 /NC. Kredit:CAO Lijuan Miljøvenlige energiomdannelsesteknologier, såsom brændselsceller og vandopdelingssystemer, har tiltrukket sig stor opm
- Hvilke to gasser produceres, når methanol brændes?
- Hvilket ville være den bedste isolator: Diamant, guld, bly eller beton?
- Hvordan udfører Corn Stivelse og Speaker Experiment
- Ny forskning finder dyb evolutionær oprindelse af et unikt pattedyrs anatomiske mønster
- Hvad er betydningen af topografiske kort?
- Hvilket materiale er mest modstandsdygtigt over for indtrængen af ioniserende stråling?


