I henhold til modellen af hydrogenatomet produceres emissionsspektret?
1. Energiniveau: BoHR -modellen beskriver hydrogenatomet som at have specifikke energiniveauer, der er betegnet med det vigtigste kvantetal (N). Det laveste energiniveau (n =1) kaldes jordtilstanden, mens højere niveauer (n =2, 3, 4 ...) kaldes ophidsede tilstande.
2. excitation: Når et elektron i et hydrogenatom absorberer energi, springer det til et højere energiniveau. Dette kan være forårsaget af forskellige måder, såsom kollisioner med andre partikler, absorption af lys eller elektrisk udladning.
3. afslapning: Den ophidsede elektron er ustabil og falder til sidst tilbage til et lavere energiniveau. Denne proces kaldes afslapning.
4. fotonemission: Når elektronet overgår fra et højere energiniveau til et lavere, frigiver det den overskydende energi som en foton af lys. Energien fra den udsendte foton er lig med forskellen i energi mellem de to niveauer.
5. Specifikke frekvenser: Da energiniveauet i hydrogenatomet er kvantiseret, er det kun specifikke energiforskelle. Dette resulterer i emission af fotoner med specifikke frekvenser (og derfor bølgelængder), hvilket svarer til de linjer, der er observeret i brintemissionsspektret.
Nøglepunkter:
* BOHR -modellen forudsiger korrekt de observerede spektrale brintlinjer.
* Hver linje i spektret svarer til en specifik elektronovergang mellem energiniveauet.
* Den mest fremtrædende serie i hydrogenemissionsspektret er Lyman -serien (UV), Balmer -serien (synlig) og Paschen Series (IR).
Eksempel:
Når et elektron i et hydrogenatom overgår fra n =3 energiniveauet til n =2 -niveauet, udsender det en foton af lys med en bølgelængde, der svarer til den røde linje i Balmer -serien.
Begrænsninger:
Mens BoHR -modellen med succes forklarer brintemissionsspektret, har den begrænsninger, når de påføres mere komplekse atomer. Modellen tegner sig ikke for den fine struktur af spektrale linjer, og den bryder sammen for atomer med mere end en elektron. Moderne kvantemekanik giver en mere komplet beskrivelse af atomstruktur og spektre.
 Varme artikler
Varme artikler
-
 Bygning af mursten fra plastaffaldKredit:Pixabay Revolutionerende grønne typer mursten og byggematerialer kunne være fremstillet af genanvendt PVC, spilde plantefibre eller sand ved hjælp af en bemærkelsesværdig ny slags gummipoly
Bygning af mursten fra plastaffaldKredit:Pixabay Revolutionerende grønne typer mursten og byggematerialer kunne være fremstillet af genanvendt PVC, spilde plantefibre eller sand ved hjælp af en bemærkelsesværdig ny slags gummipoly -
 Løsning af strukturen af ATP -syntaseStruktur af den monomere gær -ATP -syntase, vist som en overfladerepræsentation, som bestemt ved kryo-elektronmikroskopi. Kredit:Rosalind Franklin University Et team af forskere ledet af Rosalind
Løsning af strukturen af ATP -syntaseStruktur af den monomere gær -ATP -syntase, vist som en overfladerepræsentation, som bestemt ved kryo-elektronmikroskopi. Kredit:Rosalind Franklin University Et team af forskere ledet af Rosalind -
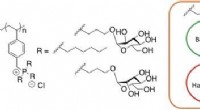 Overraskende antibakteriel aktivitet og selektivitet af hydrofile phosphoniumpolymererKredit:Wiley Kunstige polymerer, ligesom antibiotiske peptider, har brug for både hydrofobe og hydrofile domæner i deres molekylære struktur for at udøve antibakteriel aktivitet. Nu, forskere fra
Overraskende antibakteriel aktivitet og selektivitet af hydrofile phosphoniumpolymererKredit:Wiley Kunstige polymerer, ligesom antibiotiske peptider, har brug for både hydrofobe og hydrofile domæner i deres molekylære struktur for at udøve antibakteriel aktivitet. Nu, forskere fra -
 Molybdæntellurid nanoplader muliggør selektiv elektrokemisk produktion af hydrogenperoxid(a) SEM billede af MoTe2 nanoflakes. (b) (nederste panel) Polarisationskurver for MoTe2 -nanoflakes, bulk MoTe2 pulvere og grafen nanoark alene og (øverste panel) tilsvarende ringstrømme (streg linje)
Molybdæntellurid nanoplader muliggør selektiv elektrokemisk produktion af hydrogenperoxid(a) SEM billede af MoTe2 nanoflakes. (b) (nederste panel) Polarisationskurver for MoTe2 -nanoflakes, bulk MoTe2 pulvere og grafen nanoark alene og (øverste panel) tilsvarende ringstrømme (streg linje)
- Anvendelse af ethansyre
- Uddybende spørgsmål:Er en Stradivarius violin bedre end andre violiner?
- Hvilken kemisk forvitringsproces opstår, når kemikalier kombineres med vand i en reaktion for at æ…
- Skuespiller i en birolle:Substrateffekter på 2D-lag
- Hvad er emnet i Song Black Hole Sun af Soundgarden?
- Lægeservicefirma siger, at private data om udsatte patienter


