Hvorfor er CS2 en væske ved stuetemperatur, hvorimod CO2 -gastemperatur?
Her er en sammenbrud:
* cs₂ (carbon disulfid):
* svage intermolekylære kræfter: Mens CS₂ er et polært molekyle, er dets dipolmoment meget lille. Den dominerende intermolekylære kraft er London -spredningskræfter, som er relativt svage på grund af den større størrelse og større polariserbarhed af CS₂ -molekylet.
* lavere kogepunkt: Som et resultat af de svage kræfter har CS₂ et relativt lavt kogepunkt på 46 ° C. Dette betyder, at det er en væske ved stuetemperatur (ca. 25 ° C).
* co₂ (kuldioxid):
* stærkere intermolekylære kræfter: CO₂ er et lineært molekyle og er ikke -polært. Imidlertid kan det stadig deltage i London -spredningskræfter og udviser også midlertidige dipoler på grund af elektronskyfluktuationer. Disse kræfter er stærkere end i CS₂ på grund af den mindre størrelse og mindre polariserbarhed af co₂ -molekylet.
* Højere kogepunkt: De stærkere intermolekylære kræfter i CO₂ resulterer i et højere kogepunkt på -78,5 ° C. Dette betyder, at det er en gas ved stuetemperatur.
Kortfattet: Selvom både CS₂ og CO₂ er relativt små molekyler, påvirker forskellen i styrken af deres intermolekylære kræfter på grund af deres molekylære struktur og polaritet væsentligt deres kogepunkter og tilstand af stof ved stuetemperatur.
Sidste artikelHvor mange molekyler i et sandkorn?
Næste artikelHvad bruges til at vise, hvad der sker under en kemisk reaktion?
 Varme artikler
Varme artikler
-
 Ferroelektriske selvsamlede molekylære materialerDet første materiale med konduktivitetsegenskaber, der kan tændes og slukkes ved hjælp af ferroelektrisk polarisering. Kredit:Thor Balkhed Professor Martijn Kemerink fra Linköping Universitet har
Ferroelektriske selvsamlede molekylære materialerDet første materiale med konduktivitetsegenskaber, der kan tændes og slukkes ved hjælp af ferroelektrisk polarisering. Kredit:Thor Balkhed Professor Martijn Kemerink fra Linköping Universitet har -
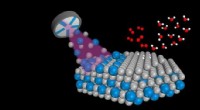 Nanolegeringer 10 gange så effektive som ren platin i brændselscellerNanolegeringer af platin (grå) og yttrium (blå) skabes ved brug af sputtering i et vakuumkammer. Dette gøres ved at rette plasma (lilla) mod et stykke platin med små vedhæftede stykker yttrium. De nan
Nanolegeringer 10 gange så effektive som ren platin i brændselscellerNanolegeringer af platin (grå) og yttrium (blå) skabes ved brug af sputtering i et vakuumkammer. Dette gøres ved at rette plasma (lilla) mod et stykke platin med små vedhæftede stykker yttrium. De nan -
 Enhed, der anvender molekylær teknik, kunne give ultrafølsomme, automatiseret system til at opdage…Jacqueline Linnes, en assisterende professor ved Purdues Weldon School of Biomedical Engineering, udvikler nukleinsyreamplifikationstest trykt på papir for at muliggøre en lav pris, automatiseret syst
Enhed, der anvender molekylær teknik, kunne give ultrafølsomme, automatiseret system til at opdage…Jacqueline Linnes, en assisterende professor ved Purdues Weldon School of Biomedical Engineering, udvikler nukleinsyreamplifikationstest trykt på papir for at muliggøre en lav pris, automatiseret syst -
 Ozon nedbryder THC aflejret på overflader fra tredjehånds cannabisrøgKredit:CC0 Public Domain Anden og tredjehånds tobaksrøg har fået masser af opmærksomhed, men meget mindre er kendt om de forbindelser, der aflejres på overflader fra cannabisrøg. Nu, forskere, der
Ozon nedbryder THC aflejret på overflader fra tredjehånds cannabisrøgKredit:CC0 Public Domain Anden og tredjehånds tobaksrøg har fået masser af opmærksomhed, men meget mindre er kendt om de forbindelser, der aflejres på overflader fra cannabisrøg. Nu, forskere, der
- Hvorfor siver metan ned på Mars? NASA-forskere har nye ideer
- Forskere forbedrer teknologi til at opdage farlige kemikalier
- Hvorfor vi ønsker at bygge en maskine, der kan forudsige en persons tiltrækningskraft
- Sådan finder du en naturlig log på en TI-30
- Hvordan organiseres organer med organer for organer?
- Hvad er energien i form eller position?


