Hvordan balanserer du sølv plus barium, og hvilken type reaktion er det?
* Metaller reagerer ikke typisk med hinanden i enkle forskydningsreaktioner. De er begge elektropositive elementer, hvilket betyder, at de har en tendens til at miste elektroner. Dette gør det usandsynligt for den ene at fortrænge den anden i en ligetil kemisk reaktion.
* For at have en reaktion har du brug for en anden type reaktant. Du har brug for noget som et salt, en syre eller et oxid for at reagere med metallerne.
Her er nogle eksempler på reaktioner, du * kunne * balance:
* sølv med bariumsalt: For eksempel kunne sølv reagere med bariumchlorid (bacl₂). I dette tilfælde ville sølv fortrænge barium:
* 2ag + bacl₂ → 2agcl + ba
* Dette er en enkelt forskydningsreaktion .
* barium med et sølvsalt: Barium kunne reagere med et sølvsalt, som sølvnitrat (Agno₃), fortrængt sølv:
* BA + 2AGNO₃ → BA (NO₃) ₂ + 2AG
* Dette er også en enkelt forskydningsreaktion .
Vigtig note: Den faktiske reaktion afhænger af de specifikke betingelser (som temperatur, koncentration og tilstedeværelsen af andre stoffer). Nogle reaktioner forekommer muligvis ikke let eller kan kræve specielle katalysatorer.
Sidste artikelHvor mange indre skalelektroner i klor?
Næste artikelHvilken type kemisk binding er kulstof og brint?
 Varme artikler
Varme artikler
-
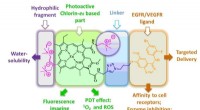 Nye meget selektive antitumor fotodynamiske terapimidler syntetiseretStrukturen af det foreslåede fotosensibilisatorkonjugat. Kredit:Lobachevsky University Et team af forskere fra Lobachevsky University (Nizhny Novgorod, Rusland) ledet af professor Alexei Fedorov
Nye meget selektive antitumor fotodynamiske terapimidler syntetiseretStrukturen af det foreslåede fotosensibilisatorkonjugat. Kredit:Lobachevsky University Et team af forskere fra Lobachevsky University (Nizhny Novgorod, Rusland) ledet af professor Alexei Fedorov -
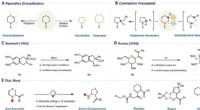 En reaktion, der fjerner svovl, nitrogen- eller oxygenatomer fra seksleddede ringe kun ved brug af b…Tilgange til piperidin-diversificering. (A) Perifer funktionalisering og skeletombygning. (B) Udvalgte eksempler på ringkontraktioner på piperidinstrukturer. (C) Grundlæggende rapport om Seebach og ko
En reaktion, der fjerner svovl, nitrogen- eller oxygenatomer fra seksleddede ringe kun ved brug af b…Tilgange til piperidin-diversificering. (A) Perifer funktionalisering og skeletombygning. (B) Udvalgte eksempler på ringkontraktioner på piperidinstrukturer. (C) Grundlæggende rapport om Seebach og ko -
 Neutroner forbedrer svejseintegriteten af undervandsvindmøllefundamenterSom vist, den neddykkede buesvejsning har en betydelig bred rille med høje iboende restspændinger. Kredit:DTU/Daniel Sommerlund Pedersen Massive offshore -strukturer som olierigge og vindmøller er
Neutroner forbedrer svejseintegriteten af undervandsvindmøllefundamenterSom vist, den neddykkede buesvejsning har en betydelig bred rille med høje iboende restspændinger. Kredit:DTU/Daniel Sommerlund Pedersen Massive offshore -strukturer som olierigge og vindmøller er -
 Visualisering af kemiske reaktioner på bimetaloverfladerEvolution af overfladestrukturer af PtNi bimetaloverflader under forskellige omgivelsesbetingelser. Kredit:KAIST Katalysatorer er resultatet af kemikere, der søger at opklare molekylernes skønhed
Visualisering af kemiske reaktioner på bimetaloverfladerEvolution af overfladestrukturer af PtNi bimetaloverflader under forskellige omgivelsesbetingelser. Kredit:KAIST Katalysatorer er resultatet af kemikere, der søger at opklare molekylernes skønhed
- Ny forskning afslører skjulte processer, der arbejder i store stjerners hjerter
- Global Payments køber Total System Services for $21,5 mia
- Cu2 Plus har hvor mange protroner og elektroner?
- Er guld kemisk bundet eller en blanding?
- Hvad er et eksempel på et kanalprotein?
- Hvilke to stoffer binder ved hjælp af en låsemekanisme?


