Hvad er ligningen for smeltet aluminiumchlorid elektrolyseret?
katode:
Al³⁺ (L) + 3E⁻ → Al (L)
anode:
2Cl⁻ (l) → Cl₂ (g) + 2e⁻
samlet reaktion:
2Alcl₃ (L) → 2Al (L) + 3Cl₂ (G)
Forklaring:
* smeltet aluminiumchlorid: Udgangsmaterialet er smeltet aluminiumchlorid, som er en væske ved høje temperaturer.
* elektrolyse: Denne proces involverer at passere en elektrisk strøm gennem det smeltede salt.
* katode: Katoden er den negative elektrode, hvor reduktion forekommer. Aluminiumioner (al³⁺) får elektroner og reduceres til flydende aluminiumsmetal.
* anode: Anoden er den positive elektrode, hvor oxidation forekommer. Chloridioner (CL⁻) mister elektroner og oxideres til klorgas.
Vigtige noter:
* Elektrolysen af smeltet aluminiumchlorid er en kommercielt vigtig proces til produktion af aluminiumsmetal.
* Processen kræver en høj temperatur (ca. 1000 ° C) for at holde aluminiumchlorid smeltet.
* Klorgassen produceret som et biprodukt kan bruges i andre industrielle processer.
Sidste artikelHvad er det kemiske navn på HG3N2?
Næste artikelEr gnidning af alkohol kovalent eller ionisk?
 Varme artikler
Varme artikler
-
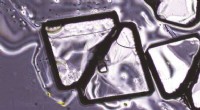 Fælles lægemiddelkilde til indsigt i dannelsen af sommerfuglekrystallerKredit:Australian Nuclear Science and Technology Organisation (ANSTO) Eksperimenter ved ANSTOs australske center for neutronspredning og den australske synkrotron har afsløret vækstmekanismen bag
Fælles lægemiddelkilde til indsigt i dannelsen af sommerfuglekrystallerKredit:Australian Nuclear Science and Technology Organisation (ANSTO) Eksperimenter ved ANSTOs australske center for neutronspredning og den australske synkrotron har afsløret vækstmekanismen bag -
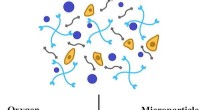 Forskere udvikler fluorescerende sensorer til at spore næringsstoffer i hydrogel-baseret helbredels…Rice Universitys bioingeniører udviklede fluorescerende mikropartikler, der kan suspenderes i hydrogelstilladser, der er podet med levende celler. Mikropartiklerne kan bruges til at overvåge tilstedev
Forskere udvikler fluorescerende sensorer til at spore næringsstoffer i hydrogel-baseret helbredels…Rice Universitys bioingeniører udviklede fluorescerende mikropartikler, der kan suspenderes i hydrogelstilladser, der er podet med levende celler. Mikropartiklerne kan bruges til at overvåge tilstedev -
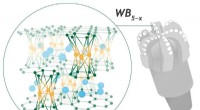 Forskere løser et 60-årigt puslespil om et superhårdt materialeForskere har knækket et puslespil fra 1960erne om krystalstrukturen i et superhardt wolframborid. Kredit:Pavel Odinev / Skoltech Skoltech forskere, sammen med deres industrielle kolleger og akadem
Forskere løser et 60-årigt puslespil om et superhårdt materialeForskere har knækket et puslespil fra 1960erne om krystalstrukturen i et superhardt wolframborid. Kredit:Pavel Odinev / Skoltech Skoltech forskere, sammen med deres industrielle kolleger og akadem -
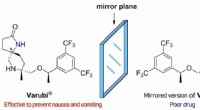 Syntetisere nyttige forbindelser uden at danne uønskede chirale partnereFigur 1 Varubi bruges sammen med anden medicin for at forhindre forsinket kvalme og opkastning forårsaget af kræftbehandling. Selvom de har de samme atomer, Varubis spejlbillede producerer ikke så meg
Syntetisere nyttige forbindelser uden at danne uønskede chirale partnereFigur 1 Varubi bruges sammen med anden medicin for at forhindre forsinket kvalme og opkastning forårsaget af kræftbehandling. Selvom de har de samme atomer, Varubis spejlbillede producerer ikke så meg
- Mere end 140 børn kan have fået fjernet hjerter i oldtidens ofring i Peru
- Hvad er formålet med ammoniumchloridpasta i tørre celler?
- Moderne afrikanere og europæere kan have flere neandertaler-forfædre end tidligere antaget
- Hvad er definitionen af højde i geologi?
- Hvordan fungerer solenergi?
- Hvad chimpanser kan lære os om økonomi


