Hvad er procentdelen afkastet, når 7,80 gram benzenforbrændinger i iltgas til dannelse af 3 CO2 og vanddamp?
1. Skriv den afbalancerede kemiske ligning:
C₆H₆ (L) + 15/2 O₂ (G) → 3 CO₂ (G) + 3 H₂O (G)
2. Beregn det teoretiske udbytte af CO₂:
* molmasse benzen (c₆h₆): 78,11 g/mol
* molmasse af co₂: 44,01 g/mol
* støkiometri: Fra den afbalancerede ligning producerer 1 mol benzen 3 mol co₂.
* gram benzen til mol: 7,80 g C₆H₆ / 78,11 g / mol =0,1 mol C₆H₆
* mol benzen til mol co₂: 0,1 mol c₆h₆ * (3 mol co₂ / 1 mol c₆h₆) =0,3 mol co₂
* mol co₂ til gram af co₂: 0,3 mol co₂ * 44,01 g/mol =13,20 g co₂
3. Beregn procentudbyttet:
* procent udbytte =(faktisk udbytte / teoretisk udbytte) * 100%
Du har ikke leveret det faktiske udbytte af CO₂ i problemet. For at beregne procentudbyttet har du brug for den faktiske mængde CO₂ produceret i eksperimentet.
Lad os antage, at du opnåede 10,5 gram co₂ i dit eksperiment:
* procent udbytte =(10,5 g co₂ / 13,20 g co₂) * 100% =79,5%
Derfor, hvis det faktiske udbytte af CO₂ er 10,5 gram, er procentudbyttet 79,5%.
Sidste artikelHvorfor fluor og klor har lignende reaktiviteter?
Næste artikelHvad er den atomiske sybmol af oxid?
 Varme artikler
Varme artikler
-
 Røget mad er mere velsmagende, mindre skadeligt med et tip fra bilindustrienKredit:CC0 Public Domain Infusion af fødevarer med røg kan give lækre nuancerede smage, men kan også komme med en uvelkommen side af kræftfremkaldende stoffer. For at reducere kræftfremkaldende in
Røget mad er mere velsmagende, mindre skadeligt med et tip fra bilindustrienKredit:CC0 Public Domain Infusion af fødevarer med røg kan give lækre nuancerede smage, men kan også komme med en uvelkommen side af kræftfremkaldende stoffer. For at reducere kræftfremkaldende in -
 Forankret af et tæt kvarter:Hvad forhindrer celler i at komme på afvejeEn kunstnerisk skildring af integrinklyngerne ved cellekanterne (glødende prikker), der bygger bro mellem matrixfibre med tæt afstand (i krikand) under dannelsen af cellematrixadhæsioner. Kredit:Nat
Forankret af et tæt kvarter:Hvad forhindrer celler i at komme på afvejeEn kunstnerisk skildring af integrinklyngerne ved cellekanterne (glødende prikker), der bygger bro mellem matrixfibre med tæt afstand (i krikand) under dannelsen af cellematrixadhæsioner. Kredit:Nat -
 Forskere finder en billigere måde at lave brintenergi ud af vandKredit:Shutterstock Brintdrevne biler kan snart blive mere end blot en nyhed, efter at et UNSW-ledet hold af forskere har demonstreret en meget billigere og bæredygtig måde at skabe den brint, der
Forskere finder en billigere måde at lave brintenergi ud af vandKredit:Shutterstock Brintdrevne biler kan snart blive mere end blot en nyhed, efter at et UNSW-ledet hold af forskere har demonstreret en meget billigere og bæredygtig måde at skabe den brint, der -
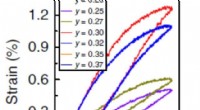 Nyt keramisk materiale kan reducere omkostningerne til piezoelektriske enhederKredit:Indian Institute of Science 1 procent), som er en markering af, hvor meget materialet kan ændre sin form, når det elektriske felt påføres. Imidlertid, de er meget dyre og svære at fremstill
Nyt keramisk materiale kan reducere omkostningerne til piezoelektriske enhederKredit:Indian Institute of Science 1 procent), som er en markering af, hvor meget materialet kan ændre sin form, når det elektriske felt påføres. Imidlertid, de er meget dyre og svære at fremstill
- Kvantemekanisk klemming muliggør atomkraftmikroskopi i kvantetilstand
- Indonesien udvider farezonen omkring ø-vulkanen
- Hvad er en måling, der inkluderer både hastighed og retning kaldet?
- Er Temple of Apollo og Sanctuary samme ting?
- Hvad er betydningen af månehalvmåne på nederste flag Tyrkiet?
- Seismisk retsmedicin og dens betydning for tidlig varsling


