Hvorfor fluor og klor har lignende reaktiviteter?
* Høj elektronegativitet: Både fluor og klor har en stærk tendens til at tiltrække elektroner. Dette gør dem meget reaktive og forsøger at få et elektron for at opnå en stabil oktetkonfiguration.
* lille atomstørrelse: Mens klor er lidt større end fluor, har de begge relativt små atomradier. Dette gør det muligt for deres ydre elektroner at være let tilgængelige og deltage i binding.
* stærk oxidationseffekt: Begge elementer accepterer let elektroner, hvilket gør dem til stærke oxidationsmidler. Dette betyder, at de let kan reagere med andre elementer og forårsage oxidation.
Imidlertid er der også nogle forskelle i reaktivitet:
* fluor er det mest reaktive element: Fluorens højere elektronegativitet og mindre atomradius gør den endnu mere reaktiv end klor. Den danner let bindinger med næsten alle elementer, inklusive ædelgasser.
* klor er mindre reaktiv end fluor: Selvom det stadig er stærkt reaktivt, er klorens reaktivitet tempereret af dens lidt større størrelse og lavere elektronegativitet.
Kortfattet:
Mens både fluor og klor udviser lignende reaktivitet på grund af deres halogen -natur og delte egenskaber, betragtes fluor generelt som det mest reaktive element på grund af dets højere elektronegativitet og mindre størrelse.
 Varme artikler
Varme artikler
-
 Video:Hvad gør gerningsstedsefterforskere egentlig?Kredit:The American Chemical Society Tv-krimidramaer har et stort publikum, men deres popularitet har fået nogle uventede konsekvenser. De har skabt interesse for retsmedicin, men de har også for
Video:Hvad gør gerningsstedsefterforskere egentlig?Kredit:The American Chemical Society Tv-krimidramaer har et stort publikum, men deres popularitet har fået nogle uventede konsekvenser. De har skabt interesse for retsmedicin, men de har også for -
 Brygning af øl, der smager frisk længereKredit:CC0 Public Domain I modsætning til vin, som generelt forbedres med tiden, øl ældes ikke godt. Normalt inden for et år efter aftapning, drikken begynder at udvikle en ubehagelig papiragtig e
Brygning af øl, der smager frisk længereKredit:CC0 Public Domain I modsætning til vin, som generelt forbedres med tiden, øl ældes ikke godt. Normalt inden for et år efter aftapning, drikken begynder at udvikle en ubehagelig papiragtig e -
 Team opdager lysdrevne katalysatorer, der danner olefiner til medicin, landbrugskemisk fremstillingOrganismer, der trives nær varme havåbninger, inspirerede en teknik af forskere fra Rice University, der bruger lys til at udløse et B12 -vitamin, der findes i thermus thermophilus, til at katalysere
Team opdager lysdrevne katalysatorer, der danner olefiner til medicin, landbrugskemisk fremstillingOrganismer, der trives nær varme havåbninger, inspirerede en teknik af forskere fra Rice University, der bruger lys til at udløse et B12 -vitamin, der findes i thermus thermophilus, til at katalysere -
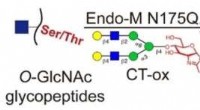 Reversibel kemoenzymatisk mærkningsstrategi muliggør dybdegående analyse af protein O-GlcNAcyleri…Kredit:Angewandte Chemie (2022). DOI:10.1002/ange.202117849 O-bundet β-N-acetylglucosamin (O-GlcNAcylation), en vigtig post-translationel modifikation (PTM) af proteiner, er involveret i forskellig
Reversibel kemoenzymatisk mærkningsstrategi muliggør dybdegående analyse af protein O-GlcNAcyleri…Kredit:Angewandte Chemie (2022). DOI:10.1002/ange.202117849 O-bundet β-N-acetylglucosamin (O-GlcNAcylation), en vigtig post-translationel modifikation (PTM) af proteiner, er involveret i forskellig
- Kraftigt jordskælv rasler fjernt fra Papua Ny Guinea
- Hvordan racemæssige stereotyper påvirker den måde, vi kommunikerer på
- Fakta om Velcro
- Billede:Mystisk joviansk mørk plet
- Nyt lægemiddel kunne forhindre invaliderende bivirkning af kræftbehandling
- Forskere studerer, hvordan nanopartikler samler sig i bestemte strukturer


