Hvorfor er klorformel CL2?
Her er hvorfor:
* Elektronisk konfiguration: Kloratomer har syv elektroner i deres yderste skal, hvilket gør dem til en elektron, der er kort efter en stabil oktetkonfiguration.
* octet regel: For at opnå stabilitet har kloratomer en tendens til at dele et elektron hver med et andet kloratom, der danner en kovalent binding.
* stabilitet: Denne deling resulterer i, at hvert kloratom effektivt har otte elektroner i sin yderste skal, opfylder oktetreglen og opnå en stabil elektronisk konfiguration.
Derfor er formlen for klor cl 2 , der repræsenterer dette naturligt forekommende diatomisk molekyle.
 Varme artikler
Varme artikler
-
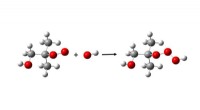 Ny type ekstremt reaktivt stof opdaget i atmosfærenReaktion:ROO + OH → ROOOH (iltatomer i rødt). Kredit:Københavns Universitet For første gang er en helt ny klasse af superreaktive kemiske forbindelser blevet opdaget under atmosfæriske forhold. For
Ny type ekstremt reaktivt stof opdaget i atmosfærenReaktion:ROO + OH → ROOOH (iltatomer i rødt). Kredit:Københavns Universitet For første gang er en helt ny klasse af superreaktive kemiske forbindelser blevet opdaget under atmosfæriske forhold. For -
 Ultra-hvid belægning modelleret på bille-skælCyphochilus bille. Kredit:Olimpia Onelli Forskere har udviklet en supertynd, ikke giftig, letvægts, spiselig ultrahvid belægning, der kunne bruges til at lave lysere maling og belægninger, til bru
Ultra-hvid belægning modelleret på bille-skælCyphochilus bille. Kredit:Olimpia Onelli Forskere har udviklet en supertynd, ikke giftig, letvægts, spiselig ultrahvid belægning, der kunne bruges til at lave lysere maling og belægninger, til bru -
 Forskere kigger ind i vandklyngedatabasen, tognetværk til at forudsige energilandskaberPNNL -forskere brugte 500, 000 vandklynger fra en nyligt udviklet database med over 5 millioner vandklynge -minima til at træne et neuralt netværk, der er afhængig af den matematiske kraft i grafteori
Forskere kigger ind i vandklyngedatabasen, tognetværk til at forudsige energilandskaberPNNL -forskere brugte 500, 000 vandklynger fra en nyligt udviklet database med over 5 millioner vandklynge -minima til at træne et neuralt netværk, der er afhængig af den matematiske kraft i grafteori -
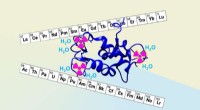 Gå ud over Moder Naturs molekyler for at målrette radioaktive metallerDet naturlige protein lanmodulin (afbildet i marineblåt) blev biokonstrueret af et samarbejde mellem forskere fra LLNL og Penn State University for bedre at opfange og adskille elementer fundet i nukl
Gå ud over Moder Naturs molekyler for at målrette radioaktive metallerDet naturlige protein lanmodulin (afbildet i marineblåt) blev biokonstrueret af et samarbejde mellem forskere fra LLNL og Penn State University for bedre at opfange og adskille elementer fundet i nukl
- Neurale netværk lærte at genkende lignende objekter på videoer uden forringelse af nøjagtighed
- Sådan skaber du trygge rum med og for sorte piger
- Hvad er strukturen af atomer?
- Hvad forårsager gastryk?
- Hvilken type organismer vil være i stand til at bruge de energi, der er gemt i organiske spildere?
- Dødelig håndtering af ulve på ét sted kan gøre tingene værre i nærheden


