Hvordan finder du den empiriske formel for et sammensat uran og fluor, der er sammensat 67,6 procent 32,4 fluor?
1. Antag en 100 g prøve
* Dette gør beregningerne lettere, da procenterne direkte oversættes til gram.
* Du har 67,6 g uran (U) og 32,4 g fluor (F).
2. Konverter gram til mol
* Opdel massen af hvert element med dets molære masse:
* uran (U): 67,6 g / 238,03 g / mol =0,284 mol
* fluor (F): 32,4 g / 19,00 g / mol =1,71 mol
3. Find molforholdet
* Opdel hver molværdi med den mindste molværdi (0,284 mol i dette tilfælde):
* uran (U): 0,284 mol / 0,284 mol =1
* fluor (F): 1,71 mol / 0,284 mol =6,03 ≈ 6
4. Skriv den empiriske formel
* Den empiriske formel repræsenterer det enkleste forhold mellem hele antal atomer i forbindelsen.
* Forholdet er 1:6 for uran og fluor.
* Derfor er den empiriske formel UF6 .
Sidste artikelKombinationen af ioner, der mindst sandsynligvis producerer et bundfald, er?
Næste artikelHvorfor er klorformel CL2?
 Varme artikler
Varme artikler
-
 Det tidløse, komplementær smag af østers og champagne - forklaretKredit:CC0 Public Domain Matchende priser er ikke den eneste grund til, at østers og champagne passer så godt sammen. Det viser en undersøgelse offentliggjort af Københavns Universitet i dag. en u
Det tidløse, komplementær smag af østers og champagne - forklaretKredit:CC0 Public Domain Matchende priser er ikke den eneste grund til, at østers og champagne passer så godt sammen. Det viser en undersøgelse offentliggjort af Københavns Universitet i dag. en u -
 Kemikere opdager måder at lave nye nitrogenprodukter ud af luftenKredit:CC0 Public Domain Et smart træk med nitrogen har bragt verden et skridt tættere på at skabe en række nyttige produkter – fra farvestoffer til lægemidler – ud af den blå luft. Opdagelsen ko
Kemikere opdager måder at lave nye nitrogenprodukter ud af luftenKredit:CC0 Public Domain Et smart træk med nitrogen har bragt verden et skridt tættere på at skabe en række nyttige produkter – fra farvestoffer til lægemidler – ud af den blå luft. Opdagelsen ko -
 Nye molekyler afledt af cannabidiol er designet med mere potente antioxidanterImmunologi professor Eduardo Muñoz. Kredit:University of Córdoba I dag, cannabidiol er en stjernekomponent, ikke kun i kosmetikkens verden, men også inden for medicin og ernæring på grund af dets
Nye molekyler afledt af cannabidiol er designet med mere potente antioxidanterImmunologi professor Eduardo Muñoz. Kredit:University of Córdoba I dag, cannabidiol er en stjernekomponent, ikke kun i kosmetikkens verden, men også inden for medicin og ernæring på grund af dets -
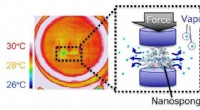 Udvikling af en ny type køling via kraftdrevet flydende gasovergangDen kølende effekt incused af sandwiched nanosvamp. Kredit:Hirotomo Nishihara Et forskerhold fra Tohoku University, Nissan Motor Co., Shinshu Universitet, og Okayama University gjorde en banebryde
Udvikling af en ny type køling via kraftdrevet flydende gasovergangDen kølende effekt incused af sandwiched nanosvamp. Kredit:Hirotomo Nishihara Et forskerhold fra Tohoku University, Nissan Motor Co., Shinshu Universitet, og Okayama University gjorde en banebryde


