Kombinationen af ioner, der mindst sandsynligvis producerer et bundfald, er?
opløselighedsregler
* generelt opløselig:
* gruppe 1 kationer (Li+, Na+, K+, RB+, CS+): Alle salte af disse kationer er opløselige.
* ammonium (NH4+): Alle ammoniumsalte er opløselige.
* nitrat (NO3-): Alle nitrater er opløselige.
* halogenider (cl-, br-, i-) :De fleste halogenider er opløselige, bortset fra dem med Ag+, Pb2+og Hg22+.
* sulfater (SO42-): De fleste sulfater er opløselige bortset fra dem med Ba2+, Sr2+, Ca2+og Pb2+.
* generelt uopløselig:
* carbonater (CO32-): De fleste carbonater er uopløselige, bortset fra dem med gruppe 1 -kationer og NH4+.
* fosfater (PO43-): De fleste fosfater er uopløselige, bortset fra dem med gruppe 1 -kationer og NH4+.
* hydroxider (OH-): De fleste hydroxider er uopløselige, bortset fra dem med gruppe 1 -kationer, Ba2+, Sr2+og Ca2+.
* sulfider (S2-): De fleste sulfider er uopløselige, bortset fra dem med gruppe 1 -kationer, gruppe 2 -kationer og NH4+.
eksempel
Lad os sige, at vi har følgende ionkombinationer:
1. Na+ og Cl- (Natriumchlorid - NaCl)
2. AG+ og Cl- (Sølvchlorid - AgCl)
3. BA2+ og SO42- (Barium Sulfate - Baso4)
4. K+ og CO32- (Kaliumcarbonat - K2CO3)
Ser på opløselighedsreglerne:
* NaCl: Både Na+ og Cl- er generelt opløselige, så NaCl ville være opløseligt.
* AGCL: Mens Cl- er generelt opløselig, er Ag+ en undtagelse og danner et uopløseligt chlorid. AGCL ville udfælde.
* baso4: Mens SO42- er generelt opløselig, er BA2+ en undtagelse og danner et uopløseligt sulfat. Baso4 ville udfælde.
* k2co3: Mens CO32- er generelt uopløselig, er K+ en gruppe 1-kation, der gør K2CO3 opløselig.
Derfor er den kombination, der mindst er sandsynlig for at producere et bundfald, Na+ og Cl- (NaCl).
Nøglepunkt: For at bestemme, om en kombination vil danne et bundfald, skal du kigge efter undtagelser fra opløselighedsreglerne. Hvis begge ioner generelt er opløselige, er det mindre sandsynligt, at det danner et bundfald.
 Varme artikler
Varme artikler
-
 Hvorfor tandpasta og cement hærder over tidUniversity of Delaware kemisk og biomolekylær ingeniørprofessor og formand Eric Furst og et team af forskere fra Ecole des Ponts og University Paris-Est i Frankrig har opdaget en proces kaldet kontakt
Hvorfor tandpasta og cement hærder over tidUniversity of Delaware kemisk og biomolekylær ingeniørprofessor og formand Eric Furst og et team af forskere fra Ecole des Ponts og University Paris-Est i Frankrig har opdaget en proces kaldet kontakt -
 Svampetøj og enheder:Biomaterialer baner vejen mod science fiction-fremtidenKredit:CC0 Public Domain Svampe er blandt verdens ældste og mest ihærdige organismer. De viser nu store løfter om at blive et af de mest nyttige materialer til fremstilling af tekstiler, gadgets o
Svampetøj og enheder:Biomaterialer baner vejen mod science fiction-fremtidenKredit:CC0 Public Domain Svampe er blandt verdens ældste og mest ihærdige organismer. De viser nu store løfter om at blive et af de mest nyttige materialer til fremstilling af tekstiler, gadgets o -
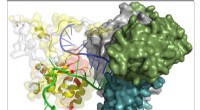 Forskere undersøger strukturen i en nøgleregion af langtidsprotein -telomeraseModel af telomerase katalytisk underenhed af H. polymorpha med fragmenter af telomerase RNA og telomert DNA. Rester, der deltager i bindingen af oligonukleotider, er markeret med rødt i TED-domæne
Forskere undersøger strukturen i en nøgleregion af langtidsprotein -telomeraseModel af telomerase katalytisk underenhed af H. polymorpha med fragmenter af telomerase RNA og telomert DNA. Rester, der deltager i bindingen af oligonukleotider, er markeret med rødt i TED-domæne -
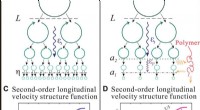 Eksperimentel observation af skalering af det elastiske område i turbulent flow med polymeradditive…Fysisk billede af den turbulente energikaskade og dens manifestation på andenordens longitudinelle hastighedsstrukturfunktion (VSF). (A og B) Tegnefilm, der viser det fysiske billede af energikaskaden
Eksperimentel observation af skalering af det elastiske område i turbulent flow med polymeradditive…Fysisk billede af den turbulente energikaskade og dens manifestation på andenordens longitudinelle hastighedsstrukturfunktion (VSF). (A og B) Tegnefilm, der viser det fysiske billede af energikaskaden
- Er bjerge og vulkaner to funktioner, der oftest findes ved pladegrænser?
- Hvad hedder navnet og formlen for salt, der er produceret i neutraliseringsvovlsyre ved kaliumhydrox…
- Hvordan kan opløselighed påvirkes?
- Hvad sker der i en syre-base reaktion ifølge Arrenhinus definition?
- Nogle Hvad stødende klipper har individuelle mineralkrystaller, der er for små til at blive set ud…
- Et overskyet mysterium:Forvirrende sky nær galaksens centrum kan indeholde spor til, hvordan stjern…


