Hvordan kan opløselighed påvirkes?
1. Temperatur:
* faste stoffer: Opløselighed af de fleste faste opløste stoffer øges med stigende temperatur. Dette skyldes, at højere temperaturer giver mere energi for, at de opløste partikler kan overvinde de attraktive kræfter, der holder dem sammen i fast tilstand.
* Gasser: Opløselighed af gasser i væsker falder generelt med stigende temperatur. Dette skyldes, at gasmolekyler ved højere temperaturer har mere energi og er mere tilbøjelige til at flygte fra opløsningen i den omgivende atmosfære.
2. Tryk:
* Gasser: Opløseligheden af gasser i væsker øges med stigende tryk. Dette forklares af Henrys lov, der siger, at opløseligheden af en gas i en væske er direkte proportional med det delvise tryk på gassen over væsken. Højere tryk tvinger flere gasmolekyler ind i væsken. Dette er grunden til, at kulsyreholdige drikkevarer flasker under pres for at opløse mere kuldioxid.
* faste stoffer og væsker: Trykket har ringe eller ingen indflydelse på opløseligheden af faste stoffer og væsker.
3. Polaritet:
* "Ligesom opløser som" Princip: Stoffer med lignende polariteter har en tendens til at opløses i hinanden. Polære opløste stoffer (f.eks. Sukker, salt) opløses godt i polære opløsningsmidler (f.eks. Vand). Ikke -polære opløste stoffer (f.eks. Olie, fedt) opløses godt i ikke -polære opløsningsmidler (f.eks. Hexan).
4. Partikelstørrelse:
* Mindre partikelstørrelse fører til hurtigere opløsning. Dette skyldes, at mindre partikler har et større overfladeareal udsat for opløsningsmidlet, hvilket øger den hastighed, hvormed opløsningen kan opløses.
5. Omrøring eller agitation:
* Omrøring eller agitation hjælper med at øge opløsningshastigheden ved at bringe frisk opløsningsmiddel i kontakt med opløsningen og ved at fjerne det opløste opløste stof fra overfladen af det faste stof, hvilket gør det muligt for mere at opløses.
6. Tilstedeværelse af andre opløste stoffer:
* Tilstedeværelsen af andre opløste stoffer kan påvirke opløseligheden af et stof. For eksempel kan tilsætning af salt til vand mindske opløseligheden af nogle gasser.
7. Kemiske reaktioner:
* Nogle stoffer kan reagere med opløsningsmidlet og ændre deres opløselighed. For eksempel opløses kuldioxid i vand for at danne kulsyre, som derefter gennemgår yderligere reaktioner.
Eksempler:
* sukker i vand: Opløseligheden af sukker i vand øges med stigende temperatur.
* kuldioxid i soda: Opløseligheden af kuldioxid i soda øges med stigende tryk.
* olie i vand: Olie er ikke -polær og vand er polær, så olie opløses ikke i vand.
At forstå disse faktorer kan hjælpe os med at forudsige og kontrollere opløseligheden af forskellige stoffer i forskellige applikationer, fra hverdagsopgaver som at brygge kaffe til komplekse industrielle processer.
 Varme artikler
Varme artikler
-
 Ny metode gør det muligt at fotografere enzymerHvis den ændrer sin polaritet, dette forårsager et ekko i den magnetiske markør, hvorfra afstanden kan beregnes. Kredit:© AG Schiemann/Uni Bonn Forskere ved universitetet i Bonn har udviklet en me
Ny metode gør det muligt at fotografere enzymerHvis den ændrer sin polaritet, dette forårsager et ekko i den magnetiske markør, hvorfra afstanden kan beregnes. Kredit:© AG Schiemann/Uni Bonn Forskere ved universitetet i Bonn har udviklet en me -
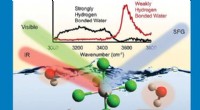 Unik grænseflade og uventet adfærd hjælper med at forklare, hvordan tungmetaller virkerForskere identificerede tre forskellige typer vandmolekyler, der omgiver en tung, anionisk metalchloridkompleks (nederst) ved brug af spektroskopi (øverst) ved en luft/vand-grænseflade. Hver type vand
Unik grænseflade og uventet adfærd hjælper med at forklare, hvordan tungmetaller virkerForskere identificerede tre forskellige typer vandmolekyler, der omgiver en tung, anionisk metalchloridkompleks (nederst) ved brug af spektroskopi (øverst) ved en luft/vand-grænseflade. Hver type vand -
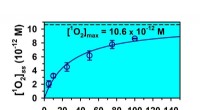 Omdannelse af absorberede fotoner med 2-oxocarboxylsyrer til yderst reaktivt singlet oxygenHøj steady-state singlet iltproduktion, [1O2]ss, under en times bestråling af luftmættede opløsninger af pyruvinsyre i vand. Kredit:Marcelo I. Guzman Forskere ved University of Kentucky fandt ud a
Omdannelse af absorberede fotoner med 2-oxocarboxylsyrer til yderst reaktivt singlet oxygenHøj steady-state singlet iltproduktion, [1O2]ss, under en times bestråling af luftmættede opløsninger af pyruvinsyre i vand. Kredit:Marcelo I. Guzman Forskere ved University of Kentucky fandt ud a -
 Analyse af fordele og ulemper ved to sammensatte fremstillingsmetoderKredit:Pixabay/CC0 Public Domain Flyvinger, vindmøllevinger, og andre store dele er typisk fremstillet ved hjælp af bulkpolymerisation i kompositproduktionsfaciliteter. De opvarmes og hærdes i eno
Analyse af fordele og ulemper ved to sammensatte fremstillingsmetoderKredit:Pixabay/CC0 Public Domain Flyvinger, vindmøllevinger, og andre store dele er typisk fremstillet ved hjælp af bulkpolymerisation i kompositproduktionsfaciliteter. De opvarmes og hærdes i eno
- Marsvin kalve udsat for neurotoksiske PCB i modermælk
- Hvad sydafrikanske kvinder fortalte os om at være hovedforsørgeren
- Hvad er vind resultatet af?
- Barca eSport -teamet skal møde andre storklubber
- Undersøgelse af koral og alger matchmaking på celleniveau
- Tombaughs opdagelse af Pluto revolutionerede viden om vores solsystem


