Ny metode gør det muligt at fotografere enzymer
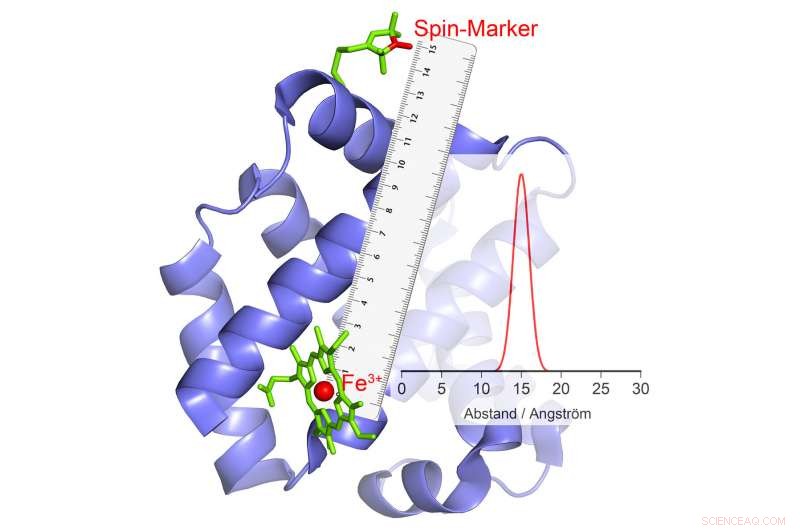
Hvis den ændrer sin polaritet, dette forårsager et ekko i den magnetiske markør, hvorfra afstanden kan beregnes. Kredit:© AG Schiemann/Uni Bonn
Forskere ved universitetet i Bonn har udviklet en metode, hvormed et enzym i arbejde kan "fotograferes". Deres metode gør det muligt bedre at forstå funktionen af vigtige biomolekyler. Forskerne håber også at få indsigt i årsagerne til visse enzymlidelser. Undersøgelsen vil blive offentliggjort i tidsskriftet Kemi – Et europæisk tidsskrift .
Hvis en udlænding så et billede af en saks for første gang i et katalog med håndværksartikler, han ville nok ikke have nogen idé om, hvad vi jordboere bruger denne ting til. Hvis, på den anden side, han skulle ses en video, hvor saksen åbner og lukker, han kunne måske udlede deres funktion med lidt fantasi.
Forskere har en meget lignende tilgang, når de vil forstå, hvordan et enzym virker:Hvis de overhovedet kender strukturen af molekylet, da normalt kun som et stillbillede. De ved ikke, hvordan enzymet opfører sig i aktion, hvilke dele bevæger sig mod hinanden, og hvilke dele bevæger sig væk fra hinanden.
Enzymer katalyserer visse kemiske reaktioner i cellerne, sammenlignes med saks, der skærer papir. De har katalytiske centre (bladene), som kommer i kontakt med udgangsmaterialet (papiret). "Den tredimensionelle form af enzymet ændrer sig normalt under denne proces, " forklarer prof. dr. Olav Schiemann fra Institut for Fysisk og Teoretisk Kemi ved Universitetet i Bonn. "Normalt, disse konformationelle ændringer kan ikke gøres synlige, eller kun med stor indsats. Dette gør det ofte svært at forstå katalysemekanismen."
Det er lykkedes Schiemanns forskergruppe at udvikle en metode, hvormed dele af proteinets bevægelser mod hinanden kan måles i katalyseforløbet. Bonn-forskerne har arbejdet på sådanne metoder med stor succes i flere år nu. I deres nuværende undersøgelse, de har undersøgt en særlig vigtig gruppe enzymer. Disse bærer metalioner med talrige uparrede elektroner i deres katalytiske centre. Et eksempel er hæmoglobin, som binder ilt ved hjælp af en jernion og dermed kan transporteres i blodet.
Vende ioner
"Vores nuværende metoder er uegnede til sådanne højspin-ioner, " forklarer Schiemanns kollega Dr. Dinar Abdullin. "Vi udviklede derfor en ny metode, udarbejdede teorien og testede den med succes." Forskerne gjorde brug af det faktum, at high-spin-ioner opfører sig som små elektromagneter. de kan tilfældigt ændre deres polaritet - de "vender":Nordpolen bliver til Sydpolen og Sydpolen bliver til Nordpolen.
Dette fænomen kan bruges til afstandsmåling. Her, forskerne forbinder enzymet med visse kemiske forbindelser, der også har elektromagnetiske egenskaber. "Når højspin-ionerne vender, disse små elektromagneter reagerer på det ændrede magnetfelt i deres omgivelser ved også at ændre deres polaritet, " forklarer Abdullin. Hvornår og hvordan de gør dette afhænger, blandt andet, på afstanden til højspin-ionen. Dette gør det muligt at bestemme afstanden mellem de to så præcist.
Hvis flere magnetiske grupper er bundet til et enzym, afstanden for hver af disse grupper til højspin-ionen og dermed til det katalytiske center opnås. "Ved at kombinere disse værdier, vi kan måle den rumlige position af dette center, som om vi brugte en molekylær GPS, " forklarer Schiemann. "F.eks. vi kan bestemme, hvordan dens position ændres i forhold til de andre magnetiske grupper i løbet af katalyse."
Imidlertid, forskerne er endnu ikke i stand til rigtig at se enzymet i arbejde. "Vi arbejder stadig med frosne celler, " siger Schiemann. "Disse indeholder adskillige enzymer, der blev frosset på forskellige tidspunkter under den katalytiske reaktion. Så vi får ikke en film, men en række "stillbilleder - som om saksen fra det indledende eksempel blev fotograferet på utallige forskellige tidspunkter under redigeringsprocessen.
"Men vi arbejder allerede på den næste forbedring, " understreger kemikeren:"Den rumlige måling af biomolekyler i celler og ved stuetemperatur." Forskerne håber at få indsigt i udviklingen af visse sygdomme, der udløses af funktionelle forstyrrelser af enzymer.
Sidste artikelRadioisotoppar til tumordiagnose og terapi
Næste artikelTidlig in vitro -test for negative virkninger på embryoner
 Varme artikler
Varme artikler
-
 Olivenmøllens spildevand omdannet:Fra forurenende stof til biogødning, biobrændstofKredit:American Chemical Society Olivenolie har længe været et populært køkkenprodukt. Men produktionen af olien skaber en stor strøm af spildevand, der kan forurene vandveje, reducere jordens f
Olivenmøllens spildevand omdannet:Fra forurenende stof til biogødning, biobrændstofKredit:American Chemical Society Olivenolie har længe været et populært køkkenprodukt. Men produktionen af olien skaber en stor strøm af spildevand, der kan forurene vandveje, reducere jordens f -
 Tumbleweeds eller fibriller:Tau-proteiner skal vælgeEt skema viser væksten af tau-oligomerer impliceret i Alzheimers og Picks sygdomme. Monomerer af tau har tendens til at aggregere langs to kanaler, den ene fører til fibriller, der danner sammenfilt
Tumbleweeds eller fibriller:Tau-proteiner skal vælgeEt skema viser væksten af tau-oligomerer impliceret i Alzheimers og Picks sygdomme. Monomerer af tau har tendens til at aggregere langs to kanaler, den ene fører til fibriller, der danner sammenfilt -
 Belysning af vibrationsenergi af et enkelt molekyle i et eksternt kraftfeltFigur 1A:Skematisk billede af et enkelt CO-molekyle i ensomhed adsorberet på en enkelt kobberkrystal. 1B:Skematiske billeder af vibrationer af et CO-molekyle adsorberet på en kobberoverflade. Et CO-mo
Belysning af vibrationsenergi af et enkelt molekyle i et eksternt kraftfeltFigur 1A:Skematisk billede af et enkelt CO-molekyle i ensomhed adsorberet på en enkelt kobberkrystal. 1B:Skematiske billeder af vibrationer af et CO-molekyle adsorberet på en kobberoverflade. Et CO-mo -
 Biologer lærte infusoria at bekæmpe giftstofferAntioxidanter modvirker de negative virkninger af brintoverilte på infusorians overlevelse Paramecium caudatum . Det ses, at antioxidanterne øger overlevelsesraten for infusorian i hydrogenperoxidop
Biologer lærte infusoria at bekæmpe giftstofferAntioxidanter modvirker de negative virkninger af brintoverilte på infusorians overlevelse Paramecium caudatum . Det ses, at antioxidanterne øger overlevelsesraten for infusorian i hydrogenperoxidop
- IGR J17503-2636 kan være en supergigantisk hurtig røntgentransient, undersøgelse finder
- Hvilke to roller spiller lichens i et økosystem?
- Et-trins produktion af aromatiske polyestere af E. coli-stammer
- Rapporten finder, at palmeolieselskabers forpligtelser mangler
- Forskere udvikler universel DNA-læser til at avancere hurtigere, billigere sekventeringsindsats
- En del af brødrene Wrights første fly på NASAs Mars-chopper


