Når en mol natriumchlorid dissocierer i vand, producerer det?
* en mol natriumioner (Na+)
* en mol chloridioner (Cl-)
Dette er repræsenteret af følgende ligning:
NaCl (s) → Na + (aq) + Cl- (aq)
Her er hvorfor:
* ioniske forbindelser: Natriumchlorid er en ionisk forbindelse, hvilket betyder, at det dannes af den elektrostatiske tiltrækning mellem positivt ladede natriumioner (Na+) og negativt ladede chloridioner (Cl-).
* opløsning i vand: Når NaCl opløses i vand, omgiver de polære vandmolekyler ionerne, hvilket svækker den elektrostatiske tiltrækning mellem dem. Dette gør det muligt for ionerne at adskille sig og blive omgivet af vandmolekyler og danne hydratiserede ioner (angivet med (aq) -symbolet).
* støkiometri: Den kemiske formel NaCI indikerer, at en mol natriumchlorid indeholder en mol natriumioner og en mol chloridioner.
Derfor, når en mol NaCl dissocierer i vand, frigiver den en mol af hver ion i opløsningen.
Sidste artikelHvorfor er H2O -hydrogendioxid i stedet for dioxid?
Næste artikelLigning for kobbernitrat og natriumcarbonat?
 Varme artikler
Varme artikler
-
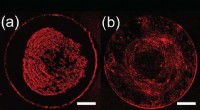 Ny fremstillingsteknik kan forbedre det almindelige problem inden for printteknologiFor figur A, der er partikeltransport til spidsen af måldråben, og der dannes en tæt midteraflejring. For figur B, den endelige kortlagte indbetaling er mere ensartet. Kredit: Langmuir En ny fr
Ny fremstillingsteknik kan forbedre det almindelige problem inden for printteknologiFor figur A, der er partikeltransport til spidsen af måldråben, og der dannes en tæt midteraflejring. For figur B, den endelige kortlagte indbetaling er mere ensartet. Kredit: Langmuir En ny fr -
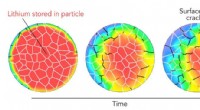 Forskere undersøger kemien i en enkelt batterielektrodepartikel både inde og udeEn simulering baseret på røntgenforsøg hos SLAC viser, hvad der sker med en enkelt batterielektrodepartikel, når den oplades i løbet af 12 minutter. Partiklen svulmer og krymper, når lithiumioner komm
Forskere undersøger kemien i en enkelt batterielektrodepartikel både inde og udeEn simulering baseret på røntgenforsøg hos SLAC viser, hvad der sker med en enkelt batterielektrodepartikel, når den oplades i løbet af 12 minutter. Partiklen svulmer og krymper, når lithiumioner komm -
 Ikke kun brød og øl:Mikrober kan fermentere kuldioxid for også at lave brændstofBicyklisk kulstoffiksering – NREL-forskere har designet en vej til at fremskynde CO2 fermentering i nogle bakteriearter. Det resulterende molekyle - acetyl-CoA, med dets to unikke kulstofhåndtag (C2)
Ikke kun brød og øl:Mikrober kan fermentere kuldioxid for også at lave brændstofBicyklisk kulstoffiksering – NREL-forskere har designet en vej til at fremskynde CO2 fermentering i nogle bakteriearter. Det resulterende molekyle - acetyl-CoA, med dets to unikke kulstofhåndtag (C2) -
 Hvilke drikkevarer sprænger med umami-potentiale?Kredit:Pixabay/CC0 Public Domain En femte grundsmag er sneget sig ind i vores konceptualisering af fødevarer i de seneste år - umami. på japansk, umami kan groft sagt oversættes til smagfuld lække
Hvilke drikkevarer sprænger med umami-potentiale?Kredit:Pixabay/CC0 Public Domain En femte grundsmag er sneget sig ind i vores konceptualisering af fødevarer i de seneste år - umami. på japansk, umami kan groft sagt oversættes til smagfuld lække
- Hvad bryder sukker ned for at fremstille energi i en plante?
- Dette hus mener, at videnskab er en trussel mod menneskeheden?
- Hvad er en tæt lomme af stof, som den begyndelsesstjerne?
- USA skriver historie med den første kvindelige rumvandring
- Hvilket formål har celler med ulige former?
- Hvad er et ekstrakromosomalt stykke bakterielt DNA, der indeholder gener, der ikke er essentielle fo…


