Et krystallinsk fast stof, der er elektrisk neutralt, har sandsynligvis bindinger?
* ioniske bindinger Involver overførsel af elektroner fra et atom til et andet, hvilket resulterer i dannelsen af positivt og negativt ladede ioner. Disse ioner arrangerer derefter sig i et almindeligt, gentagne mønster og danner en krystalgitter. Den samlede ladning af krystallen er neutral, fordi de positive og negative afgifter udbyder.
* kovalente obligationer Involver deling af elektroner mellem atomer. Denne deling kan være ens (ikke -polær kovalent) eller ulig (polær kovalent), men i begge tilfælde forbliver den samlede ladning af molekylet neutral. Krystaller dannet af kovalent bundet molekyler holdes sammen af intermolekylære kræfter (som van der Waals -kræfter eller hydrogenbindinger), som er svagere end ioniske bindinger.
* Metalliske obligationer Involver et "hav" af delokaliserede elektroner, der deles mellem et gitter af metalatomer. Mens metalliske faste stoffer er elektrisk ledende, er de stadig elektrisk neutral generelt.
Hvorfor andre typer obligationer er mindre sandsynlige:
* Hydrogenbindinger er en type intermolekylær kraft, der ikke er stærk nok til at holde en krystalstruktur sammen.
* van der Waals Forces er endnu svagere end brintbindinger og kan ikke skabe en stabil krystalstruktur.
Key Takeaway: Mens metalliske bindinger kan føre til krystallinske faste stoffer, er den mest sandsynlige bindingstype for en elektrisk neutral krystallinsk fast stof enten ionisk eller kovalent .
 Varme artikler
Varme artikler
-
 Hvor bliver surt øl så... surtØlprøver (til højre) blev indsamlet hver 2.-3. uge for at spore skiftende koncentrationer af organiske syrer og sporkomponenter under lagring i tønder (venstre). Kredit:Bryan Doty/Sour Cellars sur
Hvor bliver surt øl så... surtØlprøver (til højre) blev indsamlet hver 2.-3. uge for at spore skiftende koncentrationer af organiske syrer og sporkomponenter under lagring i tønder (venstre). Kredit:Bryan Doty/Sour Cellars sur -
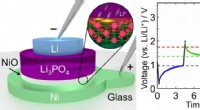 Lille, hurtig, og meget energieffektiv hukommelsesenhed inspireret af lithium-ion-batterierDe stablede lag i den foreslåede hukommelsesenhed danner et minibatteri, der hurtigt og effektivt kan skiftes mellem tre forskellige spændingstilstande (0,95 V, 1,35 V, og 1,80 V). Kredit:ACS Applied
Lille, hurtig, og meget energieffektiv hukommelsesenhed inspireret af lithium-ion-batterierDe stablede lag i den foreslåede hukommelsesenhed danner et minibatteri, der hurtigt og effektivt kan skiftes mellem tre forskellige spændingstilstande (0,95 V, 1,35 V, og 1,80 V). Kredit:ACS Applied -
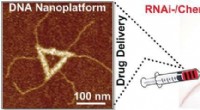 DNA origami fuld af potente kræftfremkaldende midlerKredit:Wiley En af de mest succesfulde teknikker til bekæmpelse af multilægemiddelresistens i kræftceller er nedregulering af de gener, der er ansvarlige for lægemiddelresistens. Kinesiske forsker
DNA origami fuld af potente kræftfremkaldende midlerKredit:Wiley En af de mest succesfulde teknikker til bekæmpelse af multilægemiddelresistens i kræftceller er nedregulering af de gener, der er ansvarlige for lægemiddelresistens. Kinesiske forsker -
 VCU-opfindernes håndholdte enhed bringer enorme forbedringer til vandtestprocessenPrototype af Tepper og Dodds patenterede håndholdte urandetektionsenhed; komponenter (fra venstre):pumpe, silica kammer, breadboard kredsløb Kredit:VCU School of Engineering Forhøjede niveauer af
VCU-opfindernes håndholdte enhed bringer enorme forbedringer til vandtestprocessenPrototype af Tepper og Dodds patenterede håndholdte urandetektionsenhed; komponenter (fra venstre):pumpe, silica kammer, breadboard kredsløb Kredit:VCU School of Engineering Forhøjede niveauer af
- Hvilken effekt, når for meget minedrift og stenbrud med det formål at få ædle metaller sten grus…
- Interaktive polynomiske spil
- Google vil investere 550 millioner dollars i den kinesiske e-handelsgigant JD.com
- Hvilken farve er den mest massive type hovedsekvensstjerne?
- De bevægelige klinger fra en flypropeller giver analogi til elektronet?
- Når vores planet bliver grønnere, planter bremser den globale opvarmning


