Hvorfor begyndte den overmættede opløsning at droppe små krystaller, når yderligere natriumthiosulfat blev tilsat?
Overmætning forklaret:
* opløselighed: Hvert stof har en grænse for, hvor meget det kan opløses i et givet opløsningsmiddel (som vand) ved en bestemt temperatur. Denne grænse kaldes dens opløselighed.
* overmætning: En overmættet opløsning indeholder * mere * opløst end dens opløselighedsgrænse ved en given temperatur. Dette er en usikker tilstand - løsningen er ustabil og ønsker at vende tilbage til sin normale mættede tilstand.
* Udløsende krystallisation: Selv den mindste forstyrrelse kan udløse krystallisation i en overmættet opløsning. Dette kan være at tilføje en frøkrystall, ryste beholderen eller endda en ændring i temperaturen.
Hvorfor tilføje mere natriumthiosulfat udløser krystallisation:
1. overskydende opløst stof: Tilsætning af mere natriumthiosulfat øger koncentrationen af opløsningen i opløsningen. Dette skubber opløsningen endnu længere ud over dens opløselighedsgrænse.
2. nucleation -steder: Selve det tilsatte natriumthiosulfat kan fungere som nucleationssteder. Dette er små punkter, hvor de opløste molekyler kan begynde at klumpe sammen og danne krystalstrukturer.
3. kædereaktion: Når et par krystaller begynder at dannes, fungerer de som frø til yderligere krystallisation. Tilstedeværelsen af disse krystaller gør det lettere for flere opløste molekyler at fastgøre til dem og dyrke krystallerne.
Kort sagt: Tilsætning af mere natriumthiosulfat til en allerede overmættet opløsning giver det "ekstra skub", der er nødvendigt for at overvinde ustabiliteten og udløse krystallisationsprocessen. Det overskydende opløsningsmiddel og den tilsatte natriumthiosulfat, der fungerer som nucleationssteder, starter en kaskade af krystaldannelse.
 Varme artikler
Varme artikler
-
 Afvikling af mysteriet med forringede spole-til-spole-båndEn brun klæbende skur-rester på et spole-til-hjul-bånd, der ikke kan spilles, er vist samle sig ved en afspilningsmaskines kontaktpunkter; resterne forsvinder ved opvarmning. Kredit:Andrew R. Davis
Afvikling af mysteriet med forringede spole-til-spole-båndEn brun klæbende skur-rester på et spole-til-hjul-bånd, der ikke kan spilles, er vist samle sig ved en afspilningsmaskines kontaktpunkter; resterne forsvinder ved opvarmning. Kredit:Andrew R. Davis -
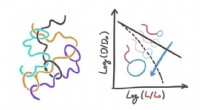 Haletudse på haletudser:Dynamikken i polymerer med en meget unik formDe er født fra foreningen mellem en cirkulær komponent og en lineær komponent og har helt særlige fysiske egenskaber. Under særlige forhold, faktisk, en opløsning af disse molekyler præsenterer sig se
Haletudse på haletudser:Dynamikken i polymerer med en meget unik formDe er født fra foreningen mellem en cirkulær komponent og en lineær komponent og har helt særlige fysiske egenskaber. Under særlige forhold, faktisk, en opløsning af disse molekyler præsenterer sig se -
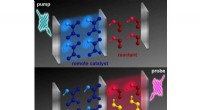 Udvikling af kemiske reaktioner med fjernbetjeningToppanel:Et kort lysudbrud interagerer med et rum, der indeholder en katalysator (vist i blåt). Bundpanel:Kort tid senere, en lignende buste af lys interagerer med en anden beholder, der indeholder re
Udvikling af kemiske reaktioner med fjernbetjeningToppanel:Et kort lysudbrud interagerer med et rum, der indeholder en katalysator (vist i blåt). Bundpanel:Kort tid senere, en lignende buste af lys interagerer med en anden beholder, der indeholder re -
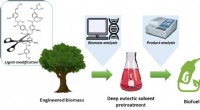 Team udvikler biobrændstofproduktionsproces i samarbejde med nordamerikanske forskereForskerne var i stand til at maksimere og kombinere potentialet i flere forskellige områder for produktion af biobrændstoffer, herunder genteknologi, procesteknologi, og analyseteknologi. Kredit:Korea
Team udvikler biobrændstofproduktionsproces i samarbejde med nordamerikanske forskereForskerne var i stand til at maksimere og kombinere potentialet i flere forskellige områder for produktion af biobrændstoffer, herunder genteknologi, procesteknologi, og analyseteknologi. Kredit:Korea
- Hvordan påvirker klimakrisen antarktisk pelssæl?
- Hvordan hungersnød dannes:I Gaza og andre steder, et underliggende mønster, der kan føre til sult…
- Reagerer sølv med ilt for at forbrænde?
- Flexion og udvidelse af kroppen?
- Blæksprutte- og blækspruttegenomundersøgelser afslører, hvordan blæksprutternes unikke egenskab…
- Hydrometer kalibreringsprocedurer


