Hvad er hydroxidionkoncentrationen af pH 4,3?
forståelse af forholdet
* pH og POH: pH og POH er relateret af følgende ligning:Ph + POH =14
* hydroxidionkoncentration: POH er den negative logaritme (base 10) af hydroxidionkoncentrationen ([OH-]):POH =-log [OH-]
Beregninger
1. Beregn POH:
* POH =14 - Ph
* POH =14 - 4.3 =9.7
2. Beregn [OH-]:
* [OH-] =10^(-POH)
* [Oh-] =10^(-9.7)
* [OH-] ≈ 2,0 x 10^(-10) m
Derfor er hydroxidionkoncentrationen af en opløsning med en pH på 4,3 ca. 2,0 x 10^(-10) m.
Sidste artikelHvad kunne gashydrater bruges til?
Næste artikelHvordan dannes luftforurening?
 Varme artikler
Varme artikler
-
 Duftfrigivende stof kan hjælpe med at neutralisere svedigt træningstøjKredit:American Chemical Society Varmt sommervejr, stressende situationer og intens træning kan forårsage ubehagelig svedig lugt. Men hvad nu hvis tøj kunne dække over disse pinlige lugte med en d
Duftfrigivende stof kan hjælpe med at neutralisere svedigt træningstøjKredit:American Chemical Society Varmt sommervejr, stressende situationer og intens træning kan forårsage ubehagelig svedig lugt. Men hvad nu hvis tøj kunne dække over disse pinlige lugte med en d -
 Nyudviklet materiale kan føre til lettere, sikrere bildesignKredit:University of Glasgow En ny form for 3-D-printet materiale fremstillet ved at kombinere almindeligt anvendt plast med carbon nanorør er hårdere og lettere end tilsvarende former for alumini
Nyudviklet materiale kan føre til lettere, sikrere bildesignKredit:University of Glasgow En ny form for 3-D-printet materiale fremstillet ved at kombinere almindeligt anvendt plast med carbon nanorør er hårdere og lettere end tilsvarende former for alumini -
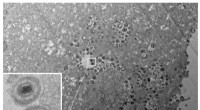 Ekstrem kulde kan afsløre herpesvirus infektionsdynamikEt transmissionselektronmikroskopbillede viser varicella-zoster-virussen. En avanceret version, kryogen elektronmikroskopi, kunne afsløre endnu flere detaljer, herunder hvordan virus inficerer celler.
Ekstrem kulde kan afsløre herpesvirus infektionsdynamikEt transmissionselektronmikroskopbillede viser varicella-zoster-virussen. En avanceret version, kryogen elektronmikroskopi, kunne afsløre endnu flere detaljer, herunder hvordan virus inficerer celler. -
 Forskere opdager en unik strækbar lederAir Force Research Laboratory udviklede Polymerized Liquid Metal Network rupturing for at forvandle sig til et meget strækbart design, der autonomt øger ledningsevnen med belastning. Kredit:Second Bay
Forskere opdager en unik strækbar lederAir Force Research Laboratory udviklede Polymerized Liquid Metal Network rupturing for at forvandle sig til et meget strækbart design, der autonomt øger ledningsevnen med belastning. Kredit:Second Bay
- Kan proteiner denatureres eller koaguleres af varmesyre?
- En organisme har følgende træk, at encellulær kan bruge fotosyntesen indeholder DNA i kerne, hvad…
- Uber lover at blive ved med at kæmpe mod en omfattende arbejdsregning i Californien
- Hvilken tilstand af materie er velkendt, men usædvanligt på jorden?
- Gamle metalkedler giver os fingerpeg om, hvad folk spiste i bronzealderen
- nordiske nationer, Nordamerikanere og antipodeanere rangerer i top i navigationsfærdigheder


