Hvad er bindingerne mellem svovl og skandium?
Her er hvorfor:
* Elektronegativitet: Svovl har en elektronegativitet på 2,58, mens skandium har en elektronegativitet på 1,36. Denne signifikante forskel i elektronegativitet indikerer, at svovl har en stærk tendens til at tiltrække elektroner, mens skandium let mister elektroner.
* iondannelse: Når svovl og skandium reagerer, mister skandium tre elektroner for at danne en +3 -kation (SC³⁺). Svovl får to elektroner til dannelse af en -2 anion (s²⁻).
* ionisk binding: Den elektrostatiske tiltrækning mellem det positivt ladede skandiumion og den negativt ladede svovlion danner en ionisk binding.
Typer af forbindelser:
Afhængig af støkiometrien kan skandium og svovl danne forskellige forbindelser som:
* skandiumsulfid (sc₂s₃): Den mest almindelige forbindelse, hvor to skandiumioner binder sig med tre svovlioner.
* skandiumpolysulfider: Dette er forbindelser med højere svovlindhold, som SC₂s₄ eller SC₂s₅.
Vigtig note: Mens den primære binding i skandiumsulfid er ionisk, kan der være en vis grad af kovalent karakter på grund af overlapningen af elektron -orbitaler. Imidlertid dominerer den ioniske natur bindingen.
 Varme artikler
Varme artikler
-
 Udskrivning flader polymerer, forbedring af elektriske og optiske egenskaberProfessor Ying Diao, venstre, postdoc forsker Kyung Sun Park, siddende, og kandidatstuderende Justin Kwok har fundet ud af, at snoede polymerer kan flades ud via printprocessen for at gøre dem bedre t
Udskrivning flader polymerer, forbedring af elektriske og optiske egenskaberProfessor Ying Diao, venstre, postdoc forsker Kyung Sun Park, siddende, og kandidatstuderende Justin Kwok har fundet ud af, at snoede polymerer kan flades ud via printprocessen for at gøre dem bedre t -
 Nye fotoresponsive hydrogeler udviklet med øje for biomedicinske applikationerFotomønsteret falmer fra hydrogel med tiden og udsættelse for luft. (Billede udlånt af Barnes laboratorium) 3-D printet, transplanterbare organer kan lyde som science fiction, men, takket være fre
Nye fotoresponsive hydrogeler udviklet med øje for biomedicinske applikationerFotomønsteret falmer fra hydrogel med tiden og udsættelse for luft. (Billede udlånt af Barnes laboratorium) 3-D printet, transplanterbare organer kan lyde som science fiction, men, takket være fre -
 Forskere udvikler katalysator, der efterligner fotosyntesens Z-skemaCu2O (til højre), der gennemgår fotokorrosion i forhold til Cu2O/TiO2 (til venstre), der fungerer under en Z-ordning for at reducere CO2. Kredit:Ruixin Zhou Et team af kemikere fra University of K
Forskere udvikler katalysator, der efterligner fotosyntesens Z-skemaCu2O (til højre), der gennemgår fotokorrosion i forhold til Cu2O/TiO2 (til venstre), der fungerer under en Z-ordning for at reducere CO2. Kredit:Ruixin Zhou Et team af kemikere fra University of K -
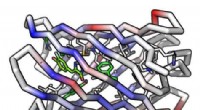 Fluorescensaktiverende beta-tøndeprotein lavet fra bunden for første gangEn computermodel af et beta-tønde-proteinmolekyle Kredit:Institute for Protein Design/UW Medicine For første gang, videnskabsmænd har skabt, helt fra bunden, et protein, der er i stand til at bind
Fluorescensaktiverende beta-tøndeprotein lavet fra bunden for første gangEn computermodel af et beta-tønde-proteinmolekyle Kredit:Institute for Protein Design/UW Medicine For første gang, videnskabsmænd har skabt, helt fra bunden, et protein, der er i stand til at bind
- Beviser tyder på, at klimapiskesmæld kan have flere ekstremer i vente for Californien
- Hvad gør kraftledninger i energi?
- Hvilken del af Torch leverer outputenergi?
- Hvordan højreekstremistiske onlinerum bruger mainstream-medier til at sprede deres ideologi
- Hvilken planet blev Voyager 1 og 2 sonder sendt til undersøgelse?
- Hvilken slags forvitring skabte de fleste kalkstenhuler?


