Et lyse linjemissionsspektrum af natrium produceres, når dets elektron?
1. Excitation:
* Når natriumatomer opvarmes eller udsættes for en højenergikilde som en flamme eller en elektrisk udladning, får deres elektroner energi.
*Disse elektroner hopper fra deres jordtilstand (laveste energiniveau) til højere energiniveau og bliver *ophidset *.
2. Afslapning:
* Spændte elektroner er ustabile og falder hurtigt tilbage til deres jordtilstand.
* Når de går tilbage ned, frigiver de den overskydende energi, de absorberede i form af lys.
3. Specifikke bølgelængder:
* Da energiniveauet i et atom kvantificeres (hvilket betyder, at de kun kan eksistere på specifikke, diskrete energiniveauer), kvantificeres den energi, der frigives under disse overgange.
* Dette betyder, at natriumatomer udsender lys ved specifikke, diskrete bølgelængder, hvilket skaber de karakteristiske lyse linjer i emissionsspektret.
Kortfattet:
Det lyse linjemissionsspektrum af natrium produceres, når dets elektroner er glade for højere energiniveau og derefter frigiver specifikke mængder energi, når de falder tilbage til deres jordtilstand og udsender lys ved specifikke bølgelængder.
Sidste artikelHvor mange ilt er et brintatomer i blegemiddel?
Næste artikelHvad er den kemiske formel til Greiss -reagens?
 Varme artikler
Varme artikler
-
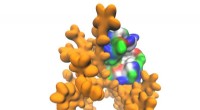 Forskere skaber multifunktionelle protein-polymerfilmDendrimer-molekyle er markeret gult. Overfladen af proteinmolekylet er farvekodet i overensstemmelse med de kemiske egenskaber af aminosyrerester (rød - positiv ladning, blå -- negativ ladning, grøn
Forskere skaber multifunktionelle protein-polymerfilmDendrimer-molekyle er markeret gult. Overfladen af proteinmolekylet er farvekodet i overensstemmelse med de kemiske egenskaber af aminosyrerester (rød - positiv ladning, blå -- negativ ladning, grøn -
 Sådan narre elektroner til at se krystallers skjulte ansigtEn nylonfiber (lyseblå), aflejret på kulstofbæreren (grå), løfter krystallen op (rød). Denne måde, krystallens sideflade bliver synlig for elektronstrålen (blå). Uden fiberen (højre figur), krystallen
Sådan narre elektroner til at se krystallers skjulte ansigtEn nylonfiber (lyseblå), aflejret på kulstofbæreren (grå), løfter krystallen op (rød). Denne måde, krystallens sideflade bliver synlig for elektronstrålen (blå). Uden fiberen (højre figur), krystallen -
 Nyudviklede screeningsprocesser vil fremskynde forskning i kulstoffangstArbejdere på Quest kulstoffangst- og lagerfacilitet i Fort Saskatchewan, Alta. U of A-forskere udtænkte en proces, der dramatisk reducerer den tid, det tager at udvikle kulstoffangstteknologier, hvilk
Nyudviklede screeningsprocesser vil fremskynde forskning i kulstoffangstArbejdere på Quest kulstoffangst- og lagerfacilitet i Fort Saskatchewan, Alta. U of A-forskere udtænkte en proces, der dramatisk reducerer den tid, det tager at udvikle kulstoffangstteknologier, hvilk -
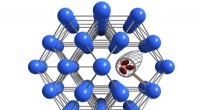 Tæmning af defekter i nanoporøse materialer for at udnytte dem godtÆndring af defekte nanoporøse materialer har unikke effekter på deres egenskaber. Swansea University-forskere søger at mestre denne metode til at lave nye materialer til at opfange CO2. Kredit:Swansea
Tæmning af defekter i nanoporøse materialer for at udnytte dem godtÆndring af defekte nanoporøse materialer har unikke effekter på deres egenskaber. Swansea University-forskere søger at mestre denne metode til at lave nye materialer til at opfange CO2. Kredit:Swansea
- Er cellemembran i prokaryotisk celle?
- Hvilken mængde bruges til at måle kraft?
- Fra skovbrandene til coronavirus, vores gamle normal er væk for altid
- Hvad er symbolet på formlen for ammoniumsulfat?
- Ansigtsgenkendelse:Kommer til en gadget nær dig
- Hvorfor bruges ikke -vedvarende energiressourcer hyppigere og derefter vedvarende?


