Hvilken er den bedste repræsentation af solvation en natriumkation i vand?
forståelse af solvation
Opløsning er processen, hvor opløste partikler (som Na+) er omgivet af opløsningsmiddelmolekyler (som vand). Dette sker på grund af attraktive kræfter mellem opløsningsmiddel og opløsningsmiddel.
natriumkation (Na+) og vand (H₂O)
* Na+: Har en positiv ladning, der tiltrækker den negative ende af vandmolekyler (iltatomet).
* h₂o: Har en delvis negativ ladning på iltatomet og en delvis positiv ladning på hydrogenatomerne på grund af dets bøjede molekylære form og polære kovalente bindinger.
Bedste repræsentation
Den bedste repræsentation af solvation af Na+ i vand skal vise:
1. natriumkation omgivet af vandmolekyler: Na+ skal være i midten, omgivet af flere vandmolekyler.
2. iltatomer mod Na+: Oxygenatomerne i vandmolekylerne skal pege mod Na+, fordi de tiltrækkes af den positive ladning.
3. hydrogenatomer, der peger væk fra Na+: Hydrogenatomerne af vandmolekylerne skal pege væk fra Na+, fordi de har en delvis positiv ladning.
Almindelige visuelle repræsentationer
* Enkel stickdiagram: Dette bruger linjer til at repræsentere bindingerne i vandmolekyler og en cirkel til Na+ -ionen. Oxygenatomerne skal placeres tæt på Na+ -ionen.
* Rumfyldningsmodel: Dette viser de relative størrelser og former for de involverede atomer, hvilket giver et mere realistisk billede af, hvordan vandmolekylerne klynger sig omkring Na+ -ionen.
Vigtig note: Det nøjagtige antal vandmolekyler, der omgiver Na+, afhænger af de specifikke betingelser (temperatur, koncentration osv.). Imidlertid forbliver det generelle princip for iltatomerne tættere på Na+ og Hydrogen -atomerne, der peger væk, det samme.
Fortæl mig, hvis du gerne vil have en bestemt type diagram, der skal beskrives!
 Varme artikler
Varme artikler
-
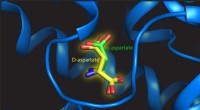 Montering af en højre hånd i en venstrehåndsvanteDenne illustration viser L- og D-aspartat på bindingsstedet for transportproteinet. Kredit:Valentina Arkhipova, University of Groningen Mange biomolekyler findes i to versioner, der er hinandens s
Montering af en højre hånd i en venstrehåndsvanteDenne illustration viser L- og D-aspartat på bindingsstedet for transportproteinet. Kredit:Valentina Arkhipova, University of Groningen Mange biomolekyler findes i to versioner, der er hinandens s -
 Nye silkematerialer kan rynkes til detaljerede mønstre, derefter rynke for at blive genoptryktVed at føre en spænding hen over et varmeelement, der er forbundet til silkelaget, udvides materialet og sletter rynkemønsteret (til venstre). Afbrydelse af spændingen tillader materialet at afkøle, o
Nye silkematerialer kan rynkes til detaljerede mønstre, derefter rynke for at blive genoptryktVed at føre en spænding hen over et varmeelement, der er forbundet til silkelaget, udvides materialet og sletter rynkemønsteret (til venstre). Afbrydelse af spændingen tillader materialet at afkøle, o -
 Forskere finder selvhelbredende katalysator til potentiel storstilet brug i brintproduktionForskerne overvejede regenerering, eller selvhelbredende -- katalysatorens evne til spontant at reparere sig selv under normale operationer -- er det mest attraktive træk. Kredit:EPFL Forskere, de
Forskere finder selvhelbredende katalysator til potentiel storstilet brug i brintproduktionForskerne overvejede regenerering, eller selvhelbredende -- katalysatorens evne til spontant at reparere sig selv under normale operationer -- er det mest attraktive træk. Kredit:EPFL Forskere, de -
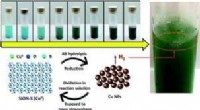
 Team udvikler separator, der reducerer gasovergang til vandelektrolysatorSammenligning af porestørrelsesfordeling af separationsmembran:KIER separationsmembran (Z75 ~ Z85), Kommerciel membran (Zirfon). Kredit:Korea Institute of Energy Research (KIER) Dr. Won-chul Cho f
Team udvikler separator, der reducerer gasovergang til vandelektrolysatorSammenligning af porestørrelsesfordeling af separationsmembran:KIER separationsmembran (Z75 ~ Z85), Kommerciel membran (Zirfon). Kredit:Korea Institute of Energy Research (KIER) Dr. Won-chul Cho f
- Løsningen på et forvirrende fænomen kan åbne døren til forbedret koldsprøjteeffektivitet
- Hvad gør en god brugshund? Hundens 'egnethedstest' kan give fingerpeg
- Et mærkeligt planetsystem omkring hurtigt-spinende stjerne passer ikke helt til eksisterende modell…
- Hvad er den vigtigste kilde til lagret energi i en marshmallow?
- Hvilke funktioner har Cecum?
- PS4, Xbox One eller Nintendo Switch:Hvilken konsol skal du købe?


