Hvorfor bruger du is i hydrolyse af ethylacetat?
* Hydrolyse af ethylacetat: Denne reaktion involverer nedbrydning af ethylacetat (en ester) i dets bestanddele:ethanol og eddikesyre. Denne reaktion udføres normalt i nærvær af en syrekatalysator, såsom svovlsyre.
* is- og reaktionstemperatur: ICE bruges primært til at kontrollere reaktionstemperaturen ved at holde den kølig. Imidlertid udføres hydrolyse af ethylacetat generelt under milde betingelser, normalt ved stuetemperatur eller let forhøjet. Brug af is ville faktisk bremse reaktionen, da reaktionshastigheden generelt er hurtigere ved højere temperaturer.
* afkøling af produktet: Mens is muligvis bruges til at afkøle reaktionsblandingen * efter * hydrolysen er komplet, ville den ikke være en almindelig praksis under selve reaktionen. Dette skyldes, at du ønsker, at reaktionen skal fortsætte effektivt og ikke være hindret.
Lad os overveje nogle mulige scenarier, hvor is kan bruges efter reaktionen:
* Kontrol af produkternes volatilitet: Hvis reaktionsblandingen indeholder flygtige komponenter (som ethanol), kan afkøling den med is hjælpe med at forhindre deres fordampning.
* adskillelse af produkter: Afkøling af reaktionsblandingen kan bruges til at størkne en komponent (f.eks. Eddikesyre), hvilket gør det lettere at adskille sig fra væskefasen.
Generelt er ICE ikke et typisk reagens i hydrolyse af ethylacetat. Det kan bruges til behandling efter reaktion, men det ville ikke blive brugt til at fremme eller lette reaktionen i sig selv.
Sidste artikelHvilken masse NaOH er indeholdt i 2,5 L A 0,010 m opløsning?
Næste artikelHvordan beskriver du et carbonatom?
 Varme artikler
Varme artikler
-
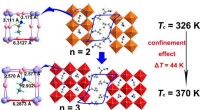 Forskere erhverver høj-Curie-temperatur lagdelt metalhalogenid ferroelektrik via bur-indesluttede e…Skematisk illustration af strategien. Kredit:Prof. LUO Junhuas gruppe Todimensionelle (2-D) organiske uorganiske hybridperovskit (OIHP) ferroelektriske stoffer har tiltrukket sig stor opmærksomhed
Forskere erhverver høj-Curie-temperatur lagdelt metalhalogenid ferroelektrik via bur-indesluttede e…Skematisk illustration af strategien. Kredit:Prof. LUO Junhuas gruppe Todimensionelle (2-D) organiske uorganiske hybridperovskit (OIHP) ferroelektriske stoffer har tiltrukket sig stor opmærksomhed -
 At finde unikke lægemiddelstrukturer med kunstig intelligens og kemiKredit:CC0 Public Domain I jagten på ny medicin mod sygdomme som kræft, et Leiden-team har udviklet en ny arbejdsgang. Denne tilgang kombinerer kunstig intelligens (AI) med molekylær modellering o
At finde unikke lægemiddelstrukturer med kunstig intelligens og kemiKredit:CC0 Public Domain I jagten på ny medicin mod sygdomme som kræft, et Leiden-team har udviklet en ny arbejdsgang. Denne tilgang kombinerer kunstig intelligens (AI) med molekylær modellering o -
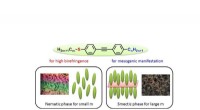 Svovl forbedrer dobbeltbrydningen til udvikling af flydende krystallinske molekylerBilleder af alkylthiogruppestavlignende molekyler, der udviser flydende krystallinitet ved stuetemperatur, og fasestrukturerne. Kredit:Toyohashi University of Technology Et team af forskere ledet
Svovl forbedrer dobbeltbrydningen til udvikling af flydende krystallinske molekylerBilleder af alkylthiogruppestavlignende molekyler, der udviser flydende krystallinitet ved stuetemperatur, og fasestrukturerne. Kredit:Toyohashi University of Technology Et team af forskere ledet -
 Usædvanlig koboltforbindelse udviklet til tyndfilmproduktionKredit:Pixabay/CC0 Public Domain Et forskerhold fra Ruhr-Universität Bochum (RUB) og Carleton University i Ottawa har fremstillet en roman, meget alsidig koboltforbindelse. Forbindelsens molekyler
Usædvanlig koboltforbindelse udviklet til tyndfilmproduktionKredit:Pixabay/CC0 Public Domain Et forskerhold fra Ruhr-Universität Bochum (RUB) og Carleton University i Ottawa har fremstillet en roman, meget alsidig koboltforbindelse. Forbindelsens molekyler
- To sfærer har identiske afgifter, og er 75 cm fra hinanden kraften mellem dem er plus 0,30 N Hvad e…
- Ledende eTextiles:Forskere går fra at lave batterier fra papir til at lave batterier af klud
- Ny biosensor designet til at detektere toksiner og mere
- Hvordan er masse forbundet med inerti?
- Granit er en klippe med lav densitet, der udgør hvilken skorpe?
- Hvad er overførslen af energi gennem rummet uden hjælp betyder noget til at bære energi?


