Er det muligt for et kemikalie at opføre sig som en syre i et tilfælde og basere en anden instans?
Her er hvorfor det er muligt:
* syrer Doner protoner (H+)
* baser Accepter protoner (H+)
Et molekyle kan fungere som både en syre og en base afhængigt af reaktionsmiljøet. Dette betyder, at det enten kan donere eller acceptere en proton, afhængigt af hvad det reagerer med.
Eksempler på amfiprotiske arter:
* vand (H2O) :
* Kan fungere som en syre:H2O → H + + OH-
* Kan fungere som base:H2O+ H+ → H3O+
* bicarbonation (HCO3-) :
* Kan fungere som en syre:HCO3- → H + + CO32-
* Kan fungere som base:HCO3- + H + → H2CO3
* aminosyrer :Disse molekyler indeholder både sure (carboxyl) og basale (amino) grupper, hvilket gør dem til fremragende eksempler på amfiprotisk opførsel.
Key Takeaway:
Opførslen af et kemikalie som en syre eller base er ikke en iboende egenskab, men snarere en funktion af dets reaktionsmiljø og de arter, det interagerer med. Amfiprotiske molekyler demonstrerer denne alsidighed og viser deres evne til at fungere som både protondonorer og acceptorer.
Sidste artikelEr calciumhydroxid lavet af binær forbindelse?
Næste artikelRepræsenterer formlen cacl2 sammensatte ioner?
 Varme artikler
Varme artikler
-
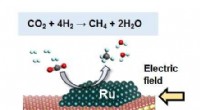 Ny metode omdanner kuldioxid til metan ved lave temperaturerHydrogenering af CO2 til CH4. Kredit:Sekine Laboratory, Waseda Universitet En ny metode udviklet af et team af Waseda-universitetets forskere under ledelse af professor Yasushi Sekine kan bidrage
Ny metode omdanner kuldioxid til metan ved lave temperaturerHydrogenering af CO2 til CH4. Kredit:Sekine Laboratory, Waseda Universitet En ny metode udviklet af et team af Waseda-universitetets forskere under ledelse af professor Yasushi Sekine kan bidrage -
 Rad afsløringer:Fremtidige brændstofdesigns fra ædle metallerKredit:Fysisk kemi Kemisk fysik Forskere ved PNNL fjerner et svøb af mystik omkring adfærden af visse metalpartikler i nukleart brændsel. Holdets resultater kan forbedre fremtidige brændselsdesig
Rad afsløringer:Fremtidige brændstofdesigns fra ædle metallerKredit:Fysisk kemi Kemisk fysik Forskere ved PNNL fjerner et svøb af mystik omkring adfærden af visse metalpartikler i nukleart brændsel. Holdets resultater kan forbedre fremtidige brændselsdesig -
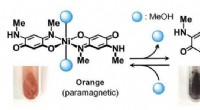 Ny type sensormateriale udvikletNikkel(II)-quinonoidkomplekser skifter deres farver og magnetisme ved at absorbere eller frigive methanol. Kredit:Hokkaido University Forskere fra Hokkaido University er lykkedes med at udvikle et
Ny type sensormateriale udvikletNikkel(II)-quinonoidkomplekser skifter deres farver og magnetisme ved at absorbere eller frigive methanol. Kredit:Hokkaido University Forskere fra Hokkaido University er lykkedes med at udvikle et -
 Forskere opdager tilgang til at aktivere inerte gasserKredit:CC0 Public Domain Inerte gasser som argon danner typisk ikke kemiske bindinger undtagen under ekstreme forhold, såsom isens kolde kulde i det ydre rum. Som delt i Proceedings of the Nationa
Forskere opdager tilgang til at aktivere inerte gasserKredit:CC0 Public Domain Inerte gasser som argon danner typisk ikke kemiske bindinger undtagen under ekstreme forhold, såsom isens kolde kulde i det ydre rum. Som delt i Proceedings of the Nationa
- Hvad sker der med energi, som din krop ikke bruger?
- Hvordan du skriver med din smartphone kan afsløre din alder – her er grunden til, at det er vigtigt
- Hvor mange ringe har et titaniumatom?
- Forskere konstruerer verdens første aerogeler lavet af skrotdæk
- Forskeren overvejer strukturelle foranstaltninger for at beskytte byer mod ekstreme varmehændelser
- Har Edwin Hubble nogensinde opfundet noget andet end teleskopet?


