Hvordan bestemte du surhedsgraden og grundlæggende af et stof?
Forståelse af surhedsgrad og grundlæggende
* surhed: Et stof er surt, hvis det donerer protoner (H+) til et andet stof. Syrer har en tendens til at have en sur smag, reagere med baser for at danne salte og vand og dreje blåt lakmuspapir rødt.
* Grundlighed: Et stof er grundlæggende (eller alkalisk), hvis det accepterer protoner (H+). Baser har en bitter smag, føles glat, reagerer med syrer for at danne salte og vand og dreje rødt lakmuspapir blåt.
Metoder til at bestemme surhedsgrad og grundlæggende
1. ph -skala: Den mest almindelige måde at måle surhedsgrad og grundlæggende på er at bruge pH -skalaen. Her er en sammenbrud:
* pH 0-6: Sur
* pH 7: Neutral (f.eks. Rent vand)
* pH 8-14: Grundlæggende
2. lakmuspapir: Denne enkle indikatorpapir ændrer farve afhængigt af opløsningens pH.
* rødt lakmuspapir bliver blåt i grundlæggende løsninger.
* blåt lakmuspapir bliver røde i sure opløsninger.
3. universal indikator: Denne opløsning ændrer farve over et bredere pH -område, hvilket giver et mere præcist estimat af pH.
4. Kemiske egenskaber:
* syrer:
* Reager med metaller for at producere brintgas (H2).
* Reager med carbonater (som bagepulver) for at producere kuldioxid (CO2).
* Drej blåt lakmuspapir rødt.
* Smag sur (prøv ikke dette derhjemme!)
* baser:
* Føl dig glat (som sæbe).
* Reager med syrer for at danne salte og vand.
* Drej rødt lakmuspapir blåt.
* Smag bitter (igen, smag ikke!).
Faktorer, der påvirker surhedsgrad og grundlæggende
* molekylær struktur: Strukturen af et molekyle bestemmer dens evne til at donere eller acceptere protoner. For eksempel er carboxylsyrer (COOH) generelt sure på grund af tilstedeværelsen af det sure hydrogenatom, der er fastgjort til carbonylgruppen.
* Elektronegativitet: Elektronegativiteten af atomer i et molekyle kan påvirke surhedsgraden eller grundlæggende. Flere elektronegative atomer trækker elektrondensitet væk fra brintatomet, hvilket gør det mere sandsynligt at blive doneret som en proton (stigende surhed).
* induktive effekter: Elektronoptagende grupper (som halogener) kan gøre et molekyle mere surt ved at trække elektrondensitet væk fra det sure brintatom.
* Resonanseffekter: Resonans kan stabilisere den konjugerede base af en syre, hvilket gør syren mere sur.
Vigtige noter:
* styrke vs. koncentration: Forvirr ikke styrken af en syre eller base med dens koncentration. En stærk syre eller base vil ioniseres fuldstændigt i opløsning, mens en svag syre eller base kun delvist ioniserer. Koncentration henviser til, hvor meget syre eller base der er til stede.
* sikkerhed: Håndter altid syrer og baser med forsigtighed. Bær passende beskyttelsesudstyr (handsker, beskyttelsesbriller) og arbejde i et godt ventileret område.
Fortæl mig, hvis du gerne vil have mere detaljerede forklaringer på nogen af disse koncepter, eller hvis du har specifikke stoffer, du gerne vil analysere!
Sidste artikelHvad er reaktion af guld III sulfat plus bariumchlorid?
Næste artikelHvad er massen af svovldioxid?
 Varme artikler
Varme artikler
-
 Ny polymer frigiver molekylær last som reaktion på kraftKumarin farvestof, det kemikalie, der er valgt som den molekylære nyttelast i denne undersøgelse, fluorescerer, når de udsættes for ultraviolet lys. Kredit:Caltech Caltech-forskere har udviklet en
Ny polymer frigiver molekylær last som reaktion på kraftKumarin farvestof, det kemikalie, der er valgt som den molekylære nyttelast i denne undersøgelse, fluorescerer, når de udsættes for ultraviolet lys. Kredit:Caltech Caltech-forskere har udviklet en -
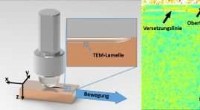 Materialeforskere studerer årsagerne til slid - permanente molekylære modifikationer opstår ved f…Når safirkuglen bevæger sig hen over kobberprøven, materialet ændres permanent. Kredit:Paul Schreiber, SÆT/IAM Slid har stor indflydelse på økonomisk effektivitet og sundhed. Alle bevægelige dele
Materialeforskere studerer årsagerne til slid - permanente molekylære modifikationer opstår ved f…Når safirkuglen bevæger sig hen over kobberprøven, materialet ændres permanent. Kredit:Paul Schreiber, SÆT/IAM Slid har stor indflydelse på økonomisk effektivitet og sundhed. Alle bevægelige dele -
 Overgangsmetalkomplekser:Blandet virker bedreIllustrationen viser et molekyle med et jernatom i centrum, bundet til 4 CN-grupper og et bipyridinmolekyle. Den højeste besatte jernbane er vist som en grøn-rød sky. Så snart en cyan gruppe er til st
Overgangsmetalkomplekser:Blandet virker bedreIllustrationen viser et molekyle med et jernatom i centrum, bundet til 4 CN-grupper og et bipyridinmolekyle. Den højeste besatte jernbane er vist som en grøn-rød sky. Så snart en cyan gruppe er til st -
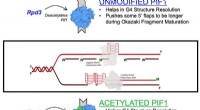 Kræftforbundet enzymmekanisme, der er nyligt karakteriseret i undersøgelseEt diagram, der illustrerer acetylering af Pif1-helicase-enzymet Kredit:Matthew Bochman og Lata Balakrishnan, Indiana University Bloomington/IUPUI En ny undersøgelse ledet af forskere ved IUPUI og
Kræftforbundet enzymmekanisme, der er nyligt karakteriseret i undersøgelseEt diagram, der illustrerer acetylering af Pif1-helicase-enzymet Kredit:Matthew Bochman og Lata Balakrishnan, Indiana University Bloomington/IUPUI En ny undersøgelse ledet af forskere ved IUPUI og
- Hvordan en skadelig svamp gør sin værtsplante forsvarsløs
- Hvad bruges geotermisk energikilde til?
- Hvad er energioverførslerne, hvis du i et løbende løb?
- Den irske lægemiddelproducent Shire står over for en potentiel budkrig på 60 milliarder dollar
- Undersøgelse finder, at emissioner fra lossepladspunktkilder har en overordnet indvirkning og giver…
- Spor af 2010 Deepwater Horizon olieudslip kan stadig spores i 2020


