Kræftforbundet enzymmekanisme, der er nyligt karakteriseret i undersøgelse
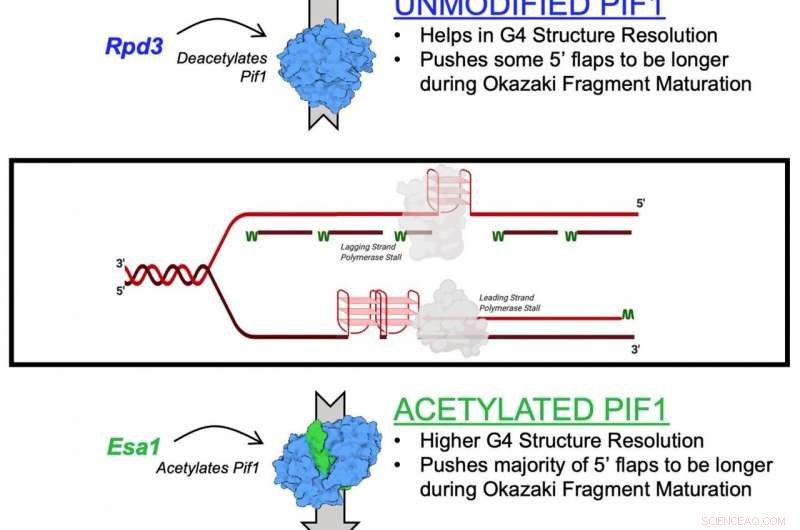
Et diagram, der illustrerer acetylering af Pif1-helicase-enzymet Kredit:Matthew Bochman og Lata Balakrishnan, Indiana University Bloomington/IUPUI
En ny undersøgelse ledet af forskere ved IUPUI og Indiana University Bloomington er den første til at beskrive en biokemisk mekanisme, der øger aktiviteten af et molekyle, hvis tilstedeværelse observeres i mange typer kræft.
Molekylet, et enzym kaldet Pif1helicase, spiller en rolle i mange vigtige cellulære processer i kroppen. En stram regulering af dette protein er afgørende for genomets stabilitet, fordi for lidt eller for meget aktivitet kan påvirke aldring og aldersrelaterede sygdomme. primært kræft. En almindelig kræftbehandling, HDAC-hæmmere, kan også udløse en stigning i dette enzym.
"I øjeblikket, vi giver folk medicin, der øger Pif-aktivitet uden fuldt ud at vide, hvordan det påvirker andre dele af cellen, der spiller en rolle i genomets stabilitet, " sagde Lata Balakrishnan, en lektor i biologi ved School of Science ved IUPUI, som er medforfatter på undersøgelsen.
"HDAC-hæmmere opregulerer visse tumor-suppressionsgener, og bruges derfor i kombinationsterapier til behandling af specifikke kræftformer, men når det kommer til deres indvirkning på andre dele af cellen, vi opererer dybest set i mørke."
Undersøgelsens anden hovedforfatter er Matthew Bochman, en lektor i IU Bloomington College of Arts and Sciences' afdeling for molekylær og cellulær biokemi. Andre medforfattere er Christopher Sausen og Onyekachi E. Ononye, Ph.D. studerende i Bochmans og Balakrishnans laboratorier, henholdsvis, på studietidspunktet.
Mekanismen beskrevet i undersøgelsen er effekten af lysinacetylering på Pif1. Lysinacetylering opstår, når et lille molekyle kaldet en acetylgruppe binder sig til lysin, en aminosyre, der bruges til at opbygge almindelige proteiner i kroppen. Denne handling transformerer lysin fra et positivt ladet molekyle til et neutralt ladet molekyle. Denne neutralisering kan påvirke proteinfunktionen, proteinstabilitet og protein-protein-interaktion i celler, blandt andet.
Helicaser er kendt som de genetiske "lynlåse" af celler, fordi de trækker DNA fra hinanden med henblik på genetisk replikation og reparation. De hjælper også med at vedligeholde telomerer, strukturen for enden af kromosomer, der forkortes, når mennesker bliver ældre.
I den nye undersøgelse, forskerne identificerede lysin-acetylering på Pif1-helicase og viste, at tilføjelsen af acetylgruppen øger proteinets aktivitet - såvel som dets "udtrækkende" funktion. De fandt også, at lysinacetylering ændrer formen - eller "konformationen" - af Pif1-proteinet. De mener, at denne formændring øger mængden af Pif1-helicase.
"Det dynamiske samspil mellem tilsætning og fjernelse af acetylgruppen på lysin regulerer en lang række proteiner i cellen, " sagde Balakrishnan. "Forstyrrelser i denne proces kan spille en rolle i kræft, aldring, inflammatoriske reaktioner og endda afhængighedsrelateret adfærd."
"Som klasse, helikaser er involveret i en masse processer, der er nødvendige for genomets integritet, " tilføjede Bochman. "Enhver væsentlig fejl i disse processer er generelt kræftfremkaldende."
De præcise detaljer om lysinacetylering i Pif1, dets virkning af enzymets form og den deraf følgende indvirkning på helicaseaktivitet tog næsten fem år at observere og rapportere. Studiet, udføres parallelt på to IU-campusser, blev muliggjort af de ledende videnskabsmænds komplementære ekspertise. Som biokemiker, der tidligere har studeret lysin-acetylering i andre proteiner, Balakrishnan var i stand til at isolere Pif1 in vitro for at observere dens reaktion på kemiske reaktioner i et reagensglas. I modsætning, som en genetiker, der arbejder i gær som en modelorganisme for at studere Pif1, Bochman var i stand til at modificere celler in vivo for at se reaktioner udspille sig i en levende organisme.
"Evnen til at observere disse reaktioner i en levende celle er ofte mere relevant, men det er også meget mere rodet, " sagde Balakrishnan. "Vores eksperimenter informerede konstant hinanden om, hvor de skulle gå videre."
Ser på fremtiden, Bochman sagde, at indviklet viden om cellulære processer - såsom lysinacetylering - i stigende grad vil spille en rolle i personlig terapi.
"Hvis du sekventerer en patients tumor, du kan finjustere medicin til at målrette meget specifikke enzymer, " sagde han. "I stedet for et lægemiddel, der bredt påvirker hele cellen, det vil være muligt at tage en målrettet tilgang, der reducerer potentielle bivirkninger. Dette niveau af personalisering er virkelig fremtiden for kræftbiologi og kræftmedicin."
 Varme artikler
Varme artikler
-
 Ny måde at støde flåter af:Tør deres spyt opKredit:CC0 Public Domain Spyt fra en skovflåts bid kan overføre patogener, der forårsager alvorlige sygdomme, såsom Lyme sygdom, og betydelige landbrugstab. Nuværende insekticider har ulemper, så
Ny måde at støde flåter af:Tør deres spyt opKredit:CC0 Public Domain Spyt fra en skovflåts bid kan overføre patogener, der forårsager alvorlige sygdomme, såsom Lyme sygdom, og betydelige landbrugstab. Nuværende insekticider har ulemper, så -
 Hvordan to vandmolekyler danser sammenKredit:CC0 Public Domain Et internationalt forskerhold har fået ny indsigt i, hvordan vandmolekyler interagerer. En laser med særlig høj lysstyrke, som findes på FELIX-laboratoriet på Radboud Univ
Hvordan to vandmolekyler danser sammenKredit:CC0 Public Domain Et internationalt forskerhold har fået ny indsigt i, hvordan vandmolekyler interagerer. En laser med særlig høj lysstyrke, som findes på FELIX-laboratoriet på Radboud Univ -
 Ny teknik kan strømline lægemiddeldesignKredit:CC0 Public Domain Forskere har udviklet en proces, der kraftigt kan reducere arbejdet involveret i computerproteindesign, ifølge en undersøgelse i Proceedings of the National Academy of Sc
Ny teknik kan strømline lægemiddeldesignKredit:CC0 Public Domain Forskere har udviklet en proces, der kraftigt kan reducere arbejdet involveret i computerproteindesign, ifølge en undersøgelse i Proceedings of the National Academy of Sc -
 Konvertering af P450 peroxygenase til peroxidase via mekanismestyret proteinteknologiFunktionel omdannelse af peroxygenase til peroxidase i DFSM-faciliteret P450BM3-H 2 O 2 system. Kredit:Ma Nana Enzymkatalyse er en lovende grøn løsning til fremstilling af lægemidler, fine kem
Konvertering af P450 peroxygenase til peroxidase via mekanismestyret proteinteknologiFunktionel omdannelse af peroxygenase til peroxidase i DFSM-faciliteret P450BM3-H 2 O 2 system. Kredit:Ma Nana Enzymkatalyse er en lovende grøn løsning til fremstilling af lægemidler, fine kem
- Nanosvampe høster sjælden kræftmarkør fra blod
- Nye nanoskalateknologier kan revolutionere mikroskoper, undersøgelse af sygdom
- Dyr, der er karnivorer i den tropiske regnskov
- Gamle mønter, armbånd plyndret fra Rumænien vender hjem
- Californiens seneste offshore-olieudslip kunne sætte skub i presset for at afslutte olieproduktione…
- Løsning af en nanoteknologisk gåde – hvad får guldatomer til at hænge sammen


