Konvertering af P450 peroxygenase til peroxidase via mekanismestyret proteinteknologi
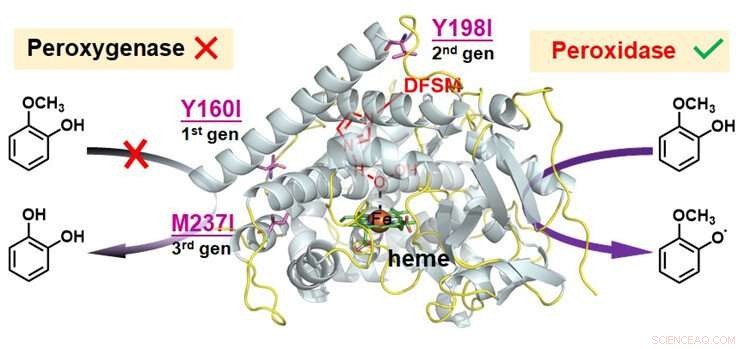
Funktionel omdannelse af peroxygenase til peroxidase i DFSM-faciliteret P450BM3-H 2 O 2 system. Kredit:Ma Nana
Enzymkatalyse er en lovende grøn løsning til fremstilling af lægemidler, fine kemikalier, og biobrændstoffer. Imidlertid, at udforske deres katalytiske promiskuitet for at udvide og forbedre enzymernes evner er fortsat udfordrende.
Et forskerhold ledet af Dr. Cong Zhiqi fra Qingdao Institute of Bioenergy and Bioprocess Technology (QIBEBT) under det kinesiske videnskabsakademi (CAS) anvendte en proteinteknikstrategi til at mutere redox-følsomme rester, der gør det muligt for peroxygenasesystemet at opnå effektiv peroxidase aktivitet.
Undersøgelsen blev offentliggjort i ACS katalyse den 28. juni.
I deres tidligere undersøgelse, forskerne rapporterede en unik H 2 O 2 -afhængigt cytochrom P450-system drevet af et dobbeltfunktionelt lille molekyle (DFSM), som udviste højeffektiv peroxygenasefunktion snarere end peroxidaseaktivitet. "Imidlertid, den katalytiske peroxidase-funktionalitet af P450s er endnu ikke fuldt ud undersøgt, " sagde Dr. Cong.
For at udvide den katalytiske promiskuitet af den DFSM-faciliterede P450-H 2 O 2 system, forskerne analyserede tre mulige katalytiske veje i systemet, og udledte, at den iboende konkurrerende oxidation af redoxfølsomme rester kan være hovedårsagen til at forhindre dets peroxidasefunktion.
De identificerede hotspots af redox-følsomme rester, og derefter brugt et lille antal logisk udvalgte aminosyrer til at udveksle resterne ved hotspots.
Efter at have kombineret flere runder iterative mutationer af redox-følsomme rester på forskellige steder, forskerne indså peroxidasefunktion af den DFSM-lettede P450-H 2 O 2 system med effektiv en-elektron-oxidationsaktivitet mod forskellige substrater. Dette system opnåede den bedste peroxidaseaktivitet af enhver P450, der er rapporteret til dato, og konkurrerede med de fleste naturlige peroxidaser.
Det kollaborative simuleringsstudie med Dr. WANG Binju fra Xiamen University viste muligheden for oprindelsen af peroxidaseaktivitet i den DFSM-faciliterede P450BM3-H 2 O 2 system fra enten fjernelse af de redoxfølsomme rester for at eliminere deres konkurrencedygtige oxidationer eller ændring af substratorientering efter proteinteknik.
"Undersøgelsen giver ny indsigt og strategier, der er relevante for at udvide den katalytiske promiskuitet af P450'er ved at kombinere virkningerne af proteinteknik og eksogene molekyler, " sagde Dr. Cong.
 Varme artikler
Varme artikler
-
 Sådan konverteres mikrogram til mikromolerEt gram er et mål på masse og er lig med 1 /1.000. af et kilogram, SI (international System) masseenhed. En mol af et givet stof er antallet af gram det stof, der indeholder 6.022 × 10 23 partik
Sådan konverteres mikrogram til mikromolerEt gram er et mål på masse og er lig med 1 /1.000. af et kilogram, SI (international System) masseenhed. En mol af et givet stof er antallet af gram det stof, der indeholder 6.022 × 10 23 partik -
 Hærens forskning lyser vejen for nye materialerUS Army Research Laboratory forskere Dr. David Baker og Dr. Joshua McClure poserer i deres laboratorium på Adelphi Laboratory Center, hvor de arbejder på at lette byrden og forbedre styrken af Soldi
Hærens forskning lyser vejen for nye materialerUS Army Research Laboratory forskere Dr. David Baker og Dr. Joshua McClure poserer i deres laboratorium på Adelphi Laboratory Center, hvor de arbejder på at lette byrden og forbedre styrken af Soldi -
 Lys giver kontrol til 3D-udskrivning med flere materialerDe øverste billeder viser det digitale design og dets trykte form. Lilla svarer til ultraviolet hærdede stive epoxidområder, der henviser til, at de grå områder er synligt lyshærdede acrylatområder, d
Lys giver kontrol til 3D-udskrivning med flere materialerDe øverste billeder viser det digitale design og dets trykte form. Lilla svarer til ultraviolet hærdede stive epoxidområder, der henviser til, at de grå områder er synligt lyshærdede acrylatområder, d -
 Forskere dechifrerer strukturen af lovende metalorganiske rammerForskere ved MIT og andre institutioner har fundet en måde at stabilisere væksten af krystaller af flere slags metalorganiske rammer, eller MOFer. Dette billede viser to scanning elektronmikroskopi
Forskere dechifrerer strukturen af lovende metalorganiske rammerForskere ved MIT og andre institutioner har fundet en måde at stabilisere væksten af krystaller af flere slags metalorganiske rammer, eller MOFer. Dette billede viser to scanning elektronmikroskopi
- Cassini billedmosaik:Et farvel til Saturn
- Tidevandsvariation af totalt suspenderet stof over Yangtze-bredden
- Tropernes brødkurv? Undersøgelse udforsker tropisk kornproduktion
- Et atom i et hulrum udvinder meget rene enkeltfotoner fra svagt laserlys
- Graphene muliggør højhastighedselektronik på fleksible materialer
- Europa okay projekt for at søge fremmed liv


