Hvor mange gram brint skal reagere, hvis reaktionen skal producere 63,5 ammoniak?
1. Skriv den afbalancerede kemiske ligning:
N₂ (G) + 3H₂ (G) → 2NH₃ (G)
2. Bestem den molære masse af ammoniak (NH₃):
* N:14,01 g/mol
* H:1,01 g/mol
* NH₃:14.01 + (3 * 1,01) =17,04 g/mol
3. Beregn molen af ammoniak:
* Mol =masse / molær masse
* Mol NH₃ =63,5 g / 17,04 g / mol =3,72 mol
4. Brug molforholdet fra den afbalancerede ligning for at finde molen af brint:
* Ligningen viser, at 3 mol H₂ reagerer på produktion af 2 mol NH₃.
* Mol H₂ =(3 mol H₂ / 2 mol NH₃) * 3,72 mol NH₃ =5,58 mol H₂
5. Beregn massen af brint:
* Masse =mol * molmasse
* Masse H₂ =5,58 mol * 2,02 g/mol = 11,27 g
Derfor skal 11,27 gram brint reagere på producent 63,5 gram ammoniak.
Sidste artikelHvad er organiseringen af organisk stof i orden?
Næste artikelHvad er den molære masse af ammoniumchlorid?
 Varme artikler
Varme artikler
-
 3-D printede elektroder frigør gassenArkitekterede 3-D elektroder:Håndtering af boblemigrering i gasudviklingsreaktioner ved høje strømtætheder. Kredit:Yat Li. Alkalisk vandelektrolyse er blevet udråbt som en vej til at etablere en b
3-D printede elektroder frigør gassenArkitekterede 3-D elektroder:Håndtering af boblemigrering i gasudviklingsreaktioner ved høje strømtætheder. Kredit:Yat Li. Alkalisk vandelektrolyse er blevet udråbt som en vej til at etablere en b -
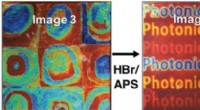 Teknik muliggør udskrivning og omskrivning af farvebillederDisse strukturelle farver blev trykt på det samme ark papir belagt med copolymerer ved anvendelse af ammoniumpersulfat og ethanol. Hydrogenbromid blev brugt til at neutralisere opløsningsmidlerne og o
Teknik muliggør udskrivning og omskrivning af farvebillederDisse strukturelle farver blev trykt på det samme ark papir belagt med copolymerer ved anvendelse af ammoniumpersulfat og ethanol. Hydrogenbromid blev brugt til at neutralisere opløsningsmidlerne og o -
 Forskere fanger molekylære kort over dyrevæv med hidtil usete detaljerDon Smith er medlem af forskningsfakultetet ved National High Magnetic Field Laboratory. Kredit:Stephen Bilenky Vi har alle hørt, og set, hvordan et billede tegner tusind ord. Nu, i en videnskabel
Forskere fanger molekylære kort over dyrevæv med hidtil usete detaljerDon Smith er medlem af forskningsfakultetet ved National High Magnetic Field Laboratory. Kredit:Stephen Bilenky Vi har alle hørt, og set, hvordan et billede tegner tusind ord. Nu, i en videnskabel -
 Detektering af kemiske midler med tillidEn Joint Chemical Agent Detector udstyret med en tærskelsikkerhedskontrol i sort, På toppen. Kredit:Jason Stoughton/NIST Joint Chemical Agent Detector (JCAD) er blevet et vigtigt forsvarsværktøj p
Detektering af kemiske midler med tillidEn Joint Chemical Agent Detector udstyret med en tærskelsikkerhedskontrol i sort, På toppen. Kredit:Jason Stoughton/NIST Joint Chemical Agent Detector (JCAD) er blevet et vigtigt forsvarsværktøj p
- Hvad er bulk -modulet af viskøst materiale?
- Nye nanopartikler svækker tumorcelleforsvar, derefter strejke med kemoterapi stof
- Hvad er ikke -levende ting i græsarealerne?
- Hvad er pH-værdien af en 0,0001M vandopløsning salpetersyre?
- Indiske astronomer undersøger røntgenpulsar 2S 1417–624
- Undersøgelse illustrerer de kombinerede effekter af klimaændringer og skovbrande


