Forekommer oxidations- og reduktionsreaktioner på samme tid?
Her er hvorfor:
* Oxidation involverer tab af elektroner af et stof.
* reduktion involverer forstærkning af elektroner af et stof.
Da elektroner ikke blot kan forsvinde eller oprettes af tynd luft, når et stof mister elektroner (oxidation), skal et andet stof få disse elektroner (reduktion).
Tænk på det som en seesaw:
* Den ene side går op (oxidation, tab af elektroner) er afbalanceret af den anden side, der går ned (reduktion, gevinst af elektroner).
Eksempel:
Overvej reaktionen mellem zink og kobber (II) sulfat:
* zn (s) + cuso₄ (aq) → znso₄ (aq) + cu (s)
I denne reaktion:
* zink (Zn) mister elektroner og er oxideret til Zn²⁺ ioner.
* kobber (II) ioner (cu²⁺) Få elektroner og er reduceret til kobbermetal (Cu).
Derfor forekommer oxidationen af zink og reduktion af kobber (II) -ioner samtidig.
Kortfattet:
* Oxidations- og reduktionsreaktioner er to uadskillelige dele af en redoxreaktion.
* De sker på samme tid, hvor et stof mister elektroner og et andet vinder dem.
* Dette sikrer bevarelse af elektroner i den overordnede proces.
 Varme artikler
Varme artikler
-
 Udførelse af forskning:Udforskning af ladningsflow gennem proteinerStuart Lindsay leder Biodesign Center for Single-Molecule Biophysics. Han har Edward og Nadine Carsons præsidentkandidat i fysik, og er også professor ved School of Molecular Sciences ved Arizona Stat
Udførelse af forskning:Udforskning af ladningsflow gennem proteinerStuart Lindsay leder Biodesign Center for Single-Molecule Biophysics. Han har Edward og Nadine Carsons præsidentkandidat i fysik, og er også professor ved School of Molecular Sciences ved Arizona Stat -
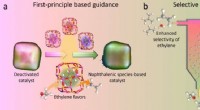 Forskere regenererer deaktiveret katalysator i methanol-til-olefin-processena. Første-principbaserede simuleringer giver kriterierne for stabilitet og funktionalitet af organiske mellemprodukter indespærret i nano-hulrum. b Selektiv omdannelse af koks til en specifik naphthal
Forskere regenererer deaktiveret katalysator i methanol-til-olefin-processena. Første-principbaserede simuleringer giver kriterierne for stabilitet og funktionalitet af organiske mellemprodukter indespærret i nano-hulrum. b Selektiv omdannelse af koks til en specifik naphthal -
 Hurtig, præcis og ikke-destruktiv:Den nye metode til at analysere fødevarekvalitetNIRS analyse af spinatplanter direkte i marken. Kredit:Universidad de Córdoba Forbrugerne leder altid efter produkter af god kvalitet, frem for alt i frisk mad som grøntsager. Men hvordan måler vi
Hurtig, præcis og ikke-destruktiv:Den nye metode til at analysere fødevarekvalitetNIRS analyse af spinatplanter direkte i marken. Kredit:Universidad de Córdoba Forbrugerne leder altid efter produkter af god kvalitet, frem for alt i frisk mad som grøntsager. Men hvordan måler vi -
 Blyfri magnetiske perovskitterKredit:CC0 Public Domain Forskere ved Linköpings Universitet, Sverige, arbejder med perovskite-materialefamilien, har udviklet en optoelektronisk magnetisk dobbeltperovskit. Opdagelsen åbner mulig
Blyfri magnetiske perovskitterKredit:CC0 Public Domain Forskere ved Linköpings Universitet, Sverige, arbejder med perovskite-materialefamilien, har udviklet en optoelektronisk magnetisk dobbeltperovskit. Opdagelsen åbner mulig
- Har to måner og halvdelen af jordens størrelse?
- Hvad er de egenskaber eller træk, som ikke alle videnskabsmand besidder?
- Er akvaporiner involveret i osmose eller lettet diffusion?
- "Unifix Cubes Activities
- Hvad er to ting, der danner dråber?
- Kinesisk ganggenkendelsesteknologi identificerer folk efter, hvordan de går


