Hvorfor opløses metan i ethanol?
Her er hvorfor:
* "som opløser som": Princippet "som opløses som" styrer opløselighed. Dette betyder, at stoffer med lignende polariteter har en tendens til at opløses i hinanden. Polære molekyler tiltrækkes af andre polære molekyler gennem dipol-dipolinteraktioner, mens ikke-polære molekyler tiltrækkes af andre ikke-polære molekyler gennem London-spredningskræfter.
* Polaritetsforskelle: Metanens tetrahedrale form og den lige deling af elektroner mellem kulstof- og hydrogenatomer gør det til et ikke -polært molekyle. Ethanol har på den anden side en polær hydroxylgruppe (OH), der skaber et betydeligt dipolmoment.
* svage interaktioner: Interaktionen mellem metan og ethanol er svag, primært baseret på London -spredningskræfter. Disse kræfter er ikke stærke nok til at overvinde de stærkere dipol-dipol-interaktioner, der er til stede mellem ethanolmolekyler.
opløses derfor ikke let i ethanol.
Vigtig note: Mens opløseligheden af methan i ethanol er meget lav, er den ikke helt nul. Der kan være en vis minimal opløsning på grund af de meget svage London -spredningskræfter, men den er ubetydelig sammenlignet med opløseligheden af andre ikke -polære molekyler i ethanol.
Sidste artikelHar CaCl2 en højde af ledningsværdien, når den blev opløst i destilleret vand?
Næste artikelHvorfor smelter zink?
 Varme artikler
Varme artikler
-
 Forskere laver næste generation, batterikomponent med høj sejhedForskning viser, at grafen (rGO) kan hjælpe med at forhindre spredning af revner i keramiske materialer, der bruges til batterielektrolytter. Kredit:Brown University Et hold af Brown University-fo
Forskere laver næste generation, batterikomponent med høj sejhedForskning viser, at grafen (rGO) kan hjælpe med at forhindre spredning af revner i keramiske materialer, der bruges til batterielektrolytter. Kredit:Brown University Et hold af Brown University-fo -
 Hjælper medikamentafgivende partikler med at presse gennem en sprøjteKredit:CC0 Public Domain Mikropartikler tilbyder en lovende måde at levere flere doser af et lægemiddel eller en vaccine på én gang, fordi de kan designes til at frigive deres nyttelast med bestem
Hjælper medikamentafgivende partikler med at presse gennem en sprøjteKredit:CC0 Public Domain Mikropartikler tilbyder en lovende måde at levere flere doser af et lægemiddel eller en vaccine på én gang, fordi de kan designes til at frigive deres nyttelast med bestem -
 Vand, jordanalyseteknologi kan hjælpe med at forbedre oprydning og overvågning på forurenede Supe…Kredit:CC0 Public Domain Mindst 53 millioner amerikanere, inklusive omkring 18 procent af landets børn, bor mindre end tre miles fra en Superfund-side, ifølge Miljøstyrelsen. Kongressen oprettede
Vand, jordanalyseteknologi kan hjælpe med at forbedre oprydning og overvågning på forurenede Supe…Kredit:CC0 Public Domain Mindst 53 millioner amerikanere, inklusive omkring 18 procent af landets børn, bor mindre end tre miles fra en Superfund-side, ifølge Miljøstyrelsen. Kongressen oprettede -
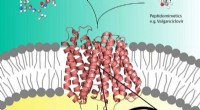 Røntgenbilleder afslører layout af lastet lægemiddeltransportørPro-lægemidler som Valganciclovir (øverst til højre) kan bruge peptidtransportøren (i midten) i cellemembranen, der normalt transporterer næringsstofpeptider (øverst til venstre) ind i cellen. Kredit:
Røntgenbilleder afslører layout af lastet lægemiddeltransportørPro-lægemidler som Valganciclovir (øverst til højre) kan bruge peptidtransportøren (i midten) i cellemembranen, der normalt transporterer næringsstofpeptider (øverst til venstre) ind i cellen. Kredit:


