Har CaCl2 en højde af ledningsværdien, når den blev opløst i destilleret vand?
* ionisk forbindelse: CaCl₂ er en ionisk forbindelse, hvilket betyder, at den let adskiller sig i dens bestanddel ioner (Ca²⁺ og 2Cl⁻), når det opløses i vand.
* Gratis ioner: Disse frie ioner er nøglen til ledningsevne. De kan bevæge sig frit inden for opløsningen og bære elektrisk ladning.
* stærk elektrolyt: Cacl₂ er en stærk elektrolyt, hvilket betyder, at den adskiller sig næsten fuldstændigt i vand. Dette resulterer i en høj koncentration af frie ioner, yderligere stigende ledningsevne.
I modsætning hertil Destilleret vand har meget lav ledningsevne, fordi det indeholder meget få ioner. Når cacl₂ opløses i destilleret vand, øges konduktiviteten dramatisk på grund af tilstedeværelsen af de meget mobile ioner.
Derfor udviser en opløsning af cacl₂ i destilleret vand en høj ledningsevneværdi.
Sidste artikelHvordan skabes brint?
Næste artikelHvorfor opløses metan i ethanol?
 Varme artikler
Varme artikler
-
 Forskere lysner vejen for at skabe en ny type MR-kontrastmiddelUT Dallas fakultetsmedlemmer, der samarbejder med Dr. Jeremiah Gassensmith (center, tilbage), lektor i kemi og biokemi, inkludere Dr. Lloyd Lumata (venstre, tilbage), adjunkt i fysik, og Dr. Steven Ni
Forskere lysner vejen for at skabe en ny type MR-kontrastmiddelUT Dallas fakultetsmedlemmer, der samarbejder med Dr. Jeremiah Gassensmith (center, tilbage), lektor i kemi og biokemi, inkludere Dr. Lloyd Lumata (venstre, tilbage), adjunkt i fysik, og Dr. Steven Ni -
 Løsning af et behåret retsmedicinsk problemKredit:American Chemical Society I årtier, retsmedicinere har testet hårstrå for at afsløre stofbrug eller forgiftning. Men i de senere år, rapporter har sat spørgsmålstegn ved teknikken - især, d
Løsning af et behåret retsmedicinsk problemKredit:American Chemical Society I årtier, retsmedicinere har testet hårstrå for at afsløre stofbrug eller forgiftning. Men i de senere år, rapporter har sat spørgsmålstegn ved teknikken - især, d -
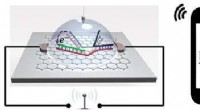 Biosensor -chip detekterer enkelt nukleotidpolymorfisme trådløst, med højere følsomhedIllustration af grafenbaseret SNP-detekteringschip, der trådløst sender signal til en smartphone. Kredit:Lal et al. Et team ledet af University of California San Diego har udviklet en chip, der ka
Biosensor -chip detekterer enkelt nukleotidpolymorfisme trådløst, med højere følsomhedIllustration af grafenbaseret SNP-detekteringschip, der trådløst sender signal til en smartphone. Kredit:Lal et al. Et team ledet af University of California San Diego har udviklet en chip, der ka -
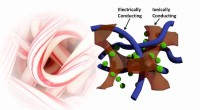 Candy cane polymer vævning kan drive fremtidige funktionelle stoffer og enhederSuperkondensatorer vævet som den røde og hvide af en slikstok kunne have øget opbevaringskapacitet i forhold til den nuværende teknologi. Kredit:Tiesheng Wang Hvis forskere nogensinde vil leve op
Candy cane polymer vævning kan drive fremtidige funktionelle stoffer og enhederSuperkondensatorer vævet som den røde og hvide af en slikstok kunne have øget opbevaringskapacitet i forhold til den nuværende teknologi. Kredit:Tiesheng Wang Hvis forskere nogensinde vil leve op
- Hvor mange protoner har darmstadtium?
- Understrukturkort viser, at mørkt stof klumper sig i galakser
- Hvad er den generelle blanding af ilt og acetylen ved svejsning?
- Hvem er far til fysik, og hvordan han relaterede til far for moderne fysik?
- Forståelse af jordens kulstoffølsomhed over for stigende globale temperaturer
- GRACE-missionsdata bidrager til vores forståelse af klimaændringer


