Hvorfor er natriumfluor en ionisk binding?
* Elektronegativitet: Fluor er det mest elektronegative element, hvilket betyder, at det har en stærk attraktion for elektroner. Natrium har på den anden side en lav elektronegativitet. Denne forskel i elektronegativitet fører til en overførsel af elektroner.
* Elektronoverførsel: Når natrium og fluor reagerer, fjerner det stærkt elektronegative fluoratom fuldstændigt den enkle valenselektron fra natriumatomet. Dette resulterer i dannelsen af et positivt ladet natriumion (Na+) og en negativt ladet fluorion (F-).
* Elektrostatisk attraktion: De modsatte ladede ioner, Na+ og F-, tiltrækkes derefter af hinanden på grund af elektrostatiske kræfter og danner en ionisk binding.
Kortfattet: Den store forskel i elektronegativitet mellem natrium og fluor forårsager en elektronoverførsel, hvilket resulterer i dannelse af modsat ladede ioner, der holdes sammen af elektrostatiske kræfter, der definerer en ionisk binding.
Sidste artikelHvad er den kemiske formel for Porphrye?
Næste artikelHvorfor er luft ikke et mineral?
 Varme artikler
Varme artikler
-
 Hvordan probiotiske bifidobakterier kunne hjælpe patienter med cøliakiKredit:CC0 Public Domain Gluten er fjende nr. 1 for dem med cøliaki, og det er svært at undgå. Episoder af denne kroniske autoimmune sygdom kan udløses ved at indtage gluten, et nøgleprotein i hve
Hvordan probiotiske bifidobakterier kunne hjælpe patienter med cøliakiKredit:CC0 Public Domain Gluten er fjende nr. 1 for dem med cøliaki, og det er svært at undgå. Episoder af denne kroniske autoimmune sygdom kan udløses ved at indtage gluten, et nøgleprotein i hve -
 Garn belagt med enzymer kan fungere som filtreOrange biokatalytisk garn med iltbobler. Kredit:Lynn Doby, multimedie specialist, Tekstiler kreative og teknologiske tjenester, Wilson College of Textiles, NC stat. North Carolina State University
Garn belagt med enzymer kan fungere som filtreOrange biokatalytisk garn med iltbobler. Kredit:Lynn Doby, multimedie specialist, Tekstiler kreative og teknologiske tjenester, Wilson College of Textiles, NC stat. North Carolina State University -
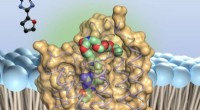 Undersøgelse viser, hvordan bioaktivt stof hæmmer vigtig receptorAdenosinantagonisten (farvet) - binder sig til bittesmå antenner på overfladen af immuncellerne, adenosinreceptorerne af type 2A. Dette bremser immunstyrkerne. Kredit:Universitetet i Bonn A2A-rec
Undersøgelse viser, hvordan bioaktivt stof hæmmer vigtig receptorAdenosinantagonisten (farvet) - binder sig til bittesmå antenner på overfladen af immuncellerne, adenosinreceptorerne af type 2A. Dette bremser immunstyrkerne. Kredit:Universitetet i Bonn A2A-rec -
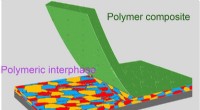 Ny teknologi har til formål at forbedre litiummetalbatteriets levetid, sikkerhedEn reaktiv polymerkomposit, billedet af den elektrokemiske grænseflade mellem lithiummetalanode og elektrolyt stabiliseres ved brug af en reaktiv polymerkomposit, muliggør højtydende genopladelige lit
Ny teknologi har til formål at forbedre litiummetalbatteriets levetid, sikkerhedEn reaktiv polymerkomposit, billedet af den elektrokemiske grænseflade mellem lithiummetalanode og elektrolyt stabiliseres ved brug af en reaktiv polymerkomposit, muliggør højtydende genopladelige lit
- Sådan fungerer Mars Odyssey
- NASA udfører felttest af 3D-billeddannelsessystem til nedstigning og landing
- Hvordan hjælper antropocæn til at genoverveje nutidige spørgsmål om miljøforringelse?
- Mangrover afgørende for miljødekontaminering
- En ny plan for at holde NASAs ældste opdagelsesrejsende i gang
- Hvordan påvirker densiteten, hvordan plader interagerer?


