Hvad er KSP for sølvcarbonat AG2CO3, hvis ionkoncentration i en mættet opløsning 0,00026 m?
Forståelse af KSP
* KSP (opløselighedsproduktkonstant): KSP er ligevægtskonstanten for opløsningen af en sparsomt opløselig ionisk forbindelse. Det repræsenterer produktet af ionkoncentrationerne, der er hævet til deres støkiometriske koefficienter i en mættet opløsning.
Opløsningsbalancen
AG₂CO₃ (S) ⇌ 2AG⁺ (aq) + co₃²⁻ (aq)
Beregning af KSP
1. Identificer de støkiometriske koefficienter: I den afbalancerede ligning produceres 2 mol Ag⁺ioner for hver 1 mol co₃²⁻ -ioner.
2. Skriv KSP -udtrykket:
KSP =[AG⁺] ² [CO₃²⁻]
3. erstatte den givne koncentration:
* [AG⁺] =0,00026 m
* Da koncentrationen af AG⁺ er dobbelt så stor som koncentrationen af co₃²⁻, [co₃²⁻] =0,00026 m / 2 =0,00013 m
4. Beregn KSP:
KSP =(0,00026) ² (0,00013)
KSP =8,79 x 10⁻¹²
Derfor er KSP for sølvcarbonat (AG₂co₃) ca. 8,79 x 10⁻¹²
 Varme artikler
Varme artikler
-
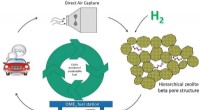 Vejen til at opnå netto-flydende brændstofEn grafisk fremstilling af, hvordan kuldioxid kan omdannes til et dieselbrændstof. Kredit:Monash University Forskere fra Monash University og Hokkaido University har udviklet en metode, der omdann
Vejen til at opnå netto-flydende brændstofEn grafisk fremstilling af, hvordan kuldioxid kan omdannes til et dieselbrændstof. Kredit:Monash University Forskere fra Monash University og Hokkaido University har udviklet en metode, der omdann -
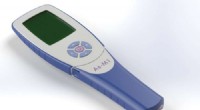 Enkel arsenføler kan redde livPrototypen arsenik sensor. Kredit:Bio Nano Consulting En lavpris, brugervenlig sensor, der kan teste drikkevand for arsen på bare et minut, er blevet udviklet af Imperial- og UCL-forskere. I hele
Enkel arsenføler kan redde livPrototypen arsenik sensor. Kredit:Bio Nano Consulting En lavpris, brugervenlig sensor, der kan teste drikkevand for arsen på bare et minut, er blevet udviklet af Imperial- og UCL-forskere. I hele -
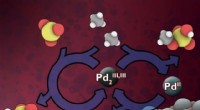 En ny måde at udnytte spildt metan påMIT kemiprofessor Yogesh Surendranath og tre kolleger har fundet en måde at bruge elektricitet på, som potentielt kan komme fra vedvarende kilder, at omdanne metan til derivater af methanol. Forskerne
En ny måde at udnytte spildt metan påMIT kemiprofessor Yogesh Surendranath og tre kolleger har fundet en måde at bruge elektricitet på, som potentielt kan komme fra vedvarende kilder, at omdanne metan til derivater af methanol. Forskerne -
 Bionedbrydeligt emballage udviklet til økologisk skønhedsmarkedKredit:Heriot-Watt University Ny, Bionedbrydelig emballage er udviklet for at hjælpe kosmetikfirmaer med at imødekomme kundernes efterspørgsel efter miljøvenlig emballage. Den nye emballage løser
Bionedbrydeligt emballage udviklet til økologisk skønhedsmarkedKredit:Heriot-Watt University Ny, Bionedbrydelig emballage er udviklet for at hjælpe kosmetikfirmaer med at imødekomme kundernes efterspørgsel efter miljøvenlig emballage. Den nye emballage løser
- Ny undersøgelse den første til at kortlægge flugtveje for brandmænd fra vildmarken fra luften
- Ingeniøren er stadig bekymret over forebyggelse af sporing af Safari
- Hvorfor falder temperaturen, når reaktionen når støkiometrisk punkt?
- Film viser, at nanorør bøjes som træge guitarstrenge
- Hvorfor bruger videnskabsmand astronomiske enheder?
- Nedbrydes saccharose til brint og ilt?


