Hvad holder ionerne sammen i en krystal?
Her er en sammenbrud:
* ioner: Ioner er atomer, der har opnået eller mistet elektroner, hvilket giver dem en nettopositiv eller negativ ladning.
* Elektrostatisk attraktion: Modsatte anklager tiltrækker. I en ionisk krystal tiltrækkes positivt ladede ioner (kationer) af negativt ladede ioner (anioner). Denne attraktion er den drivende kraft, der holder ionerne sammen i en stiv, tredimensionel struktur.
Tænk på det som magneter:
* Den positive ende af en ion fungerer som Nordpolen i en magnet.
* Den negative ende af en anden ion fungerer som Sydpolen.
* De modsatte poler tiltrækker og danner en stærk bånd.
nøgleegenskaber for ioniske krystaller:
* højt smeltepunkt: De stærke elektrostatiske kræfter kræver en masse energi for at bryde, hvilket resulterer i høje smeltepunkter.
* hårdt og sprødt: Den stive struktur gør dem hårde, men ionerne er arrangeret i et specifikt mønster. Hvis strukturen forstyrres, kan ionerne let glide forbi hinanden, hvilket får krystallen til at sprænge.
* Led elektricitet, når den er smeltet eller opløst: Ionerne holdes tæt i krystalstrukturen. Men når de er smeltet eller opløst, kan de bevæge sig frit, så de kan bære en elektrisk strøm.
Eksempler:
* natriumchlorid (NaCl) - Bordsalt
* calciumoxid (CAO) - kalk
* kaliumfluorid (KF) - Brugt i tandpasta
Fortæl mig, hvis du har andre spørgsmål!
Sidste artikelForhold efter antal atomer i merkurøst chlorid?
Næste artikelHvad er de i gram af et fluoratom?
 Varme artikler
Varme artikler
-
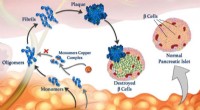 Kobberioner kan spille en nøglerolle, når peptidfoldning går galtKobberioner (røde kugler) kan vedhæfte peptidmonomerer (blå) og forhindre dem i at klumpe sig sammen for at danne oligomerer, fibriller og skadelige plaketter. © 2020 Mawadda Alghrably Afvikling a
Kobberioner kan spille en nøglerolle, når peptidfoldning går galtKobberioner (røde kugler) kan vedhæfte peptidmonomerer (blå) og forhindre dem i at klumpe sig sammen for at danne oligomerer, fibriller og skadelige plaketter. © 2020 Mawadda Alghrably Afvikling a -
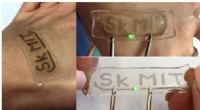 Team udvikler enkel hydrogelmodifikationsmetode mod strækbar og gennemsigtig elektronikSWCNT/hydrogel-baseret mønstret kredsløb afbildet på tre måder:knyttet til menneskelig hud, afslappet, og strakt med 50 pct. Kredit:Skoltech Forskere fra Skolkovo Institute of Science and Technolo
Team udvikler enkel hydrogelmodifikationsmetode mod strækbar og gennemsigtig elektronikSWCNT/hydrogel-baseret mønstret kredsløb afbildet på tre måder:knyttet til menneskelig hud, afslappet, og strakt med 50 pct. Kredit:Skoltech Forskere fra Skolkovo Institute of Science and Technolo -
 Letvægts elektriske armbåndsvarmere til konstant, bærbar varmeEt elektrisk ledende og holdbart garn blev syet på stof og blev en bærbar varmelegeme (høje temperaturer angivet med gule og røde), når der blev påført en sikker spænding. Kredit:American Chemical Soc
Letvægts elektriske armbåndsvarmere til konstant, bærbar varmeEt elektrisk ledende og holdbart garn blev syet på stof og blev en bærbar varmelegeme (høje temperaturer angivet med gule og røde), når der blev påført en sikker spænding. Kredit:American Chemical Soc -
 Molekylær magnetisme pakker strøm med messenger -elektronAtomer på tilstødende molekyler som dette kan kobles til en lang, magnetisk kæde, skabe en ny type magnetisk struktur, siger John Berry, professor i kemi ved University of Wisconsin-Madison. Kredit:Da
Molekylær magnetisme pakker strøm med messenger -elektronAtomer på tilstødende molekyler som dette kan kobles til en lang, magnetisk kæde, skabe en ny type magnetisk struktur, siger John Berry, professor i kemi ved University of Wisconsin-Madison. Kredit:Da
- Er Alaminion jernholdigt eller ikke jernholdigt?
- Hvad er ordligningen for korrosion af kobber?
- Hvad er Ecoshphere?
- Hvor meget arbejde i Joules udføres, når en kraft på 800,0 N udøves, mens du skubber kassen på …
- Hvad hedder et objekt, der kun lader lidt lys igennem?
- Hvordan klassificerer forskere et element baseret på hvilke kriterier?


