Kobberioner kan spille en nøglerolle, når peptidfoldning går galt
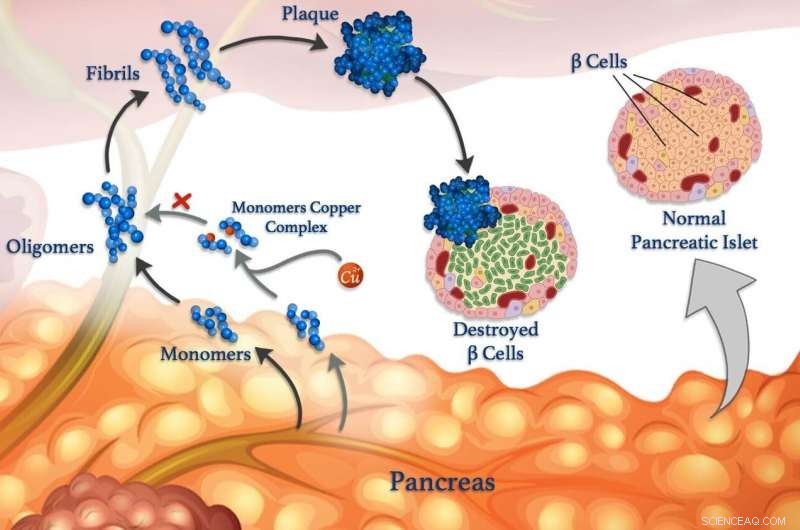
Kobberioner (røde kugler) kan vedhæfte peptidmonomerer (blå) og forhindre dem i at klumpe sig sammen for at danne oligomerer, fibriller og skadelige plaketter. © 2020 Mawadda Alghrably
Afvikling af interaktioner mellem metalioner og peptider i kroppen kan i sidste ende føre til forbedrede behandlinger af diabetes, Alzheimers og andre sygdomme. Forståelse af disse interaktioner er forskningens fokus, ledet af KAUST, det afslører, hvordan metaller, såsom kobber, kan påvirke dannelsen af skadelige klumper af fejlfoldede peptidklynger kaldet fibriller, som ligger til grund for mange sygdomme.
Fejlagtige peptider er knyttet til neurologiske tilstande såsom Alzheimers, samt til blodsukkerkontrol sygdom diabetes. Blodsukkerniveauet kontrolleres normalt via peptidhormoner frigivet af specialiserede celler kaldet β-celler. Samt insulin, raske β-celler frigiver også amylin, et peptidhormon, der hjælper med at reducere stigninger i blodsukkerniveauet efter at have spist ved at bremse mavetømningen. Men amylin er tilbøjelig til at danne fejlfoldede klumper, især i nærvær af kobberioner, der skader β-celler og bidrager til type II diabetes.
Imidlertid, metalioner kan også modvirke peptidaggregation under visse omstændigheder, siger KAUST -forsker, Mariusz Jaremko, der ledede arbejdet i samarbejde med forskere fra University of Wroclaw i Polen. For at studere processen mere detaljeret, teamet undersøger interaktionen mellem kobber (II) ioner og amylin og dets molekylære analoger. "Sådan viden ville give os indsigt i de molekylære mekanismer ved type II -diabetes, gør det muligt for os at designe nye strategier og terapier mod denne sygdom, "Siger Jaremko.
I deres seneste arbejde, teamet undersøgte kobberioners indflydelse på sammenlægningen af to analoger af humant amylin:et amylin-efterlignende lægemiddel kaldet pramlintid og amylin fra rotter. "Vi fandt ud af, at forskelle i strukturerne af pramlintid og rotteamylin betyder, at kobberioner forhindrer aggregering af pramlintid, men ikke rotte -amylin, "siger Mawadda Alghrably, en ph.d. elev i Jaremkos team.
Forskerne undersøgte processen ved hjælp af flere teknikker, herunder nuklear magnetisk resonans (i samarbejde med Abdul-Hamid Emwas fra KAUST CoreLabs), og et "thioflavin T" -fluorescensassay af proteinaggregering. De fandt ud af, at selvom begge amylinanaloger binder kobber, pramlintid kunne binde det på to forskellige måder på grund af en ekstra kobberbindende histidin-aminosyre, der er til stede i pramlintid, men ikke rotte-amylin. Kobber-ionbinding til dette histidin forklarede sandsynligvis, hvorfor kobber reducerede pramlintidaggregation, men ikke rotte-amylin-aggregering, konkluderede forskerne.
Teamet fortsætter med at dechifrere det molekylære grundlag for amylin -aggregering, Alghrably siger. "Forståelse for hvordan disse molekyler opfører sig, i sidste ende kunne bidrage til at lette designet af nye effektive lægemidler og terapier til type II -diabetes, " hun siger.
 Varme artikler
Varme artikler
-
 Lys i mørket:Ny opdagelse gør mikroskopisk billeddannelse mulig under mørke forholdStyring af kemiluminescens i to dimensioner. Kredit:Dr Yan Vogel, Curtin Universitet Curtin University-forskere har opdaget en ny måde at analysere mikroskopiske prøver mere nøjagtigt på ved i det
Lys i mørket:Ny opdagelse gør mikroskopisk billeddannelse mulig under mørke forholdStyring af kemiluminescens i to dimensioner. Kredit:Dr Yan Vogel, Curtin Universitet Curtin University-forskere har opdaget en ny måde at analysere mikroskopiske prøver mere nøjagtigt på ved i det -
 Fælder for energikildemolekyler i cellerKredit:Natalia Deryugina Et team af forskere, inklusive en RUDN-kemiker, har syntetiseret nye molekyler, der tilhører klassen af calixarener, skållignende hule strukturer. Disse stoffer ser ud t
Fælder for energikildemolekyler i cellerKredit:Natalia Deryugina Et team af forskere, inklusive en RUDN-kemiker, har syntetiseret nye molekyler, der tilhører klassen af calixarener, skållignende hule strukturer. Disse stoffer ser ud t -
 Forskere undersøger indflydelsen af svampehud på aromaerne af most og vinKredit:CC0 Public Domain Yoghurt, øl, brød og specialiteter som velsmagende blå oste eller god vin - specielle mikroorganismer og raffineringsprocesser frembringer først de behagelige smag og fris
Forskere undersøger indflydelsen af svampehud på aromaerne af most og vinKredit:CC0 Public Domain Yoghurt, øl, brød og specialiteter som velsmagende blå oste eller god vin - specielle mikroorganismer og raffineringsprocesser frembringer først de behagelige smag og fris -
 Interaktion med nukleart affald i miljøet kan være mere kompliceret, end man engang troedeDen glødende/lyserøde prøve på højre side er en egentlig prøve, der indeholder radioaktivt curium og proteinet lanmodulin, under et fluorescensspektroskopiforsøg ved LLNL. Proteinet får curium til at
Interaktion med nukleart affald i miljøet kan være mere kompliceret, end man engang troedeDen glødende/lyserøde prøve på højre side er en egentlig prøve, der indeholder radioaktivt curium og proteinet lanmodulin, under et fluorescensspektroskopiforsøg ved LLNL. Proteinet får curium til at
- Nanostrukturer bliver bedre til at høste sollys til generering af soldamp
- NASAs felttest fokuserer på videnskab om lava-terræner, der ligner tidlige Mars
- Tilpasser meninger om klimaændringer sig til økonomiske forhold?
- Ekspansionsmikroskopi og virtual reality belyser nye måder at forebygge og behandle sygdom på
- Hvordan man kan reducere fattigdom og genskabe forbindelse mellem mennesker og naturen
- Ny måde at forhindre gensplejsede og uændrede organismer i at producere afkom


