Hvorfor er ammoniumtetrahedral formet?
1. hybridisering: Nitrogenatomet i ammonium gennemgår SP³ -hybridisering. Dette betyder, at 2'erne orbital og tre 2p orbitaler af nitrogenblanding til dannelse af fire ækvivalente sp³ hybrid orbitaler. Disse orbitaler er arrangeret tetrahedralt omkring nitrogenatomet.
2. ensomt par: Nitrogen i sin jordtilstand har fem valenselektroner. I ammonium danner nitrogen fire kovalente bindinger med fire hydrogenatomer ved hjælp af alle dets valenselektroner. Nitrogen har dog stadig et ensomt par elektroner, men det er ikke til stede i bindingsstrukturen og påvirker derfor ikke formen.
3. frastødning: De fire sp³ -hybrid -orbitaler, der hver indeholder et ensomt par, oplever maksimal frastødning, når den er arrangeret i en tetrahedral form. Dette skyldes, at dette arrangement minimerer den elektronelektroniske frastødning mellem bindingsparene, hvilket resulterer i en stabil og lavenergikonfiguration.
4. VSEPR -teori: Valence Shell Electron Pair Repulsion (VSEPR) -teorien forudsiger geometrien af et molekyle baseret på antallet af elektronpar omkring det centrale atom. I tilfælde af ammonium er der fire elektronpar omkring nitrogenatomet (fire bindingspar), hvilket fører til et tetrahedralt arrangement.
På grund af hybridiseringen af nitrogen, det ensomme par og frastødelsen mellem elektronpar udviser ammonium en tetrahedral form.
Sidste artikelVil KCl og H2O danne en homogen blanding?
Næste artikelHvad er den grundlæggende bestanddel af alt organisk stof?
 Varme artikler
Varme artikler
-
 Forskere udvikler open source-software til at analysere økonomien ved biobrændstoffer, bioprodukte…Ledende BioSTEAM-softwareudvikler Yoel Cortes-Pena. Kredit:Center for Avanceret Biobrændstof og Bioproduktinnovation (CABBI) Flerårige græsser kan omdannes til alt fra ethanol til bioplast, men de
Forskere udvikler open source-software til at analysere økonomien ved biobrændstoffer, bioprodukte…Ledende BioSTEAM-softwareudvikler Yoel Cortes-Pena. Kredit:Center for Avanceret Biobrændstof og Bioproduktinnovation (CABBI) Flerårige græsser kan omdannes til alt fra ethanol til bioplast, men de -
 Biosensorteknologier til at tilbyde mere effektive tilgange til sygdomsbehandlingMonash Biomedicine Discovery Institutes professor Mibel Aguilar og Dr. John Lee ved siden af den nyudviklede biosensorteknologi. Kredit:Steve Morton Hver celle i vores kroppe er formet af dens y
Biosensorteknologier til at tilbyde mere effektive tilgange til sygdomsbehandlingMonash Biomedicine Discovery Institutes professor Mibel Aguilar og Dr. John Lee ved siden af den nyudviklede biosensorteknologi. Kredit:Steve Morton Hver celle i vores kroppe er formet af dens y -
 C. elegans rundorme høster et vigtigt coenzym fra de bakterier, de indtagerCaenorhabditis elegans. Kredit:Wikipedia En undersøgelse udført i C. elegans nematode rundorm kan føre til forbedret behandling af en sjælden menneskelig genetisk lidelse, der forårsager alvorli
C. elegans rundorme høster et vigtigt coenzym fra de bakterier, de indtagerCaenorhabditis elegans. Kredit:Wikipedia En undersøgelse udført i C. elegans nematode rundorm kan føre til forbedret behandling af en sjælden menneskelig genetisk lidelse, der forårsager alvorli -
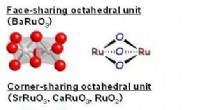 Bariumruthenat:Et højt udbytte, lethåndterlig perovskitkatalysator til oxidation af sulfiderØverst:Skematiske repræsentationer af ansigtsdelingsenheden i romboedrisk BaRuO 3 og hjørnedelingsenhed i tetragonal RuO 2 , kubisk SrRuO 3 , og orthorhombisk CaRuO 3 . Nederst:Scanning elektr
Bariumruthenat:Et højt udbytte, lethåndterlig perovskitkatalysator til oxidation af sulfiderØverst:Skematiske repræsentationer af ansigtsdelingsenheden i romboedrisk BaRuO 3 og hjørnedelingsenhed i tetragonal RuO 2 , kubisk SrRuO 3 , og orthorhombisk CaRuO 3 . Nederst:Scanning elektr
- Hvad er et stof, der blokerer for strømmen af varme eller elektricitet?
- Secrets of nanohair adhæsion un-peeled af UA polymer videnskabsmænd
- In-sensor computing for at fremskynde maskinsyn
- Hvordan så Jorden ud i den prækambriske tidsperiode?
- Hvorfor NASA-astronauter er forsinkede på rumstationen efter Boeing Starliner-lanceringen
- Beviser for vedvarende skovafhængighed af oprindelige folk i det historiske Sri Lanka


